博文
恒容热(Qv)与恒压热(Qp)的正确关系
|
化学反应 aA(g)+bB(aq)→cC(g)+dD(aq)的恒压热(Qp)与恒容热(QV)的定量关系为:Qp=QV+Σνi(g)▪RT (1)
式(1)中νi(g)代表气相物质i的化学计量系数; R=8.314J▪mol-1▪K-1;T为反应进行温度,单位为K.
本文拟依据热力学基本原理,探讨式(1)的科学性.
1. 恒温恒压或恒温恒容条件
恒温恒压及恒温恒容是热力学常见的化学反应条件,恒压常通过敞口反应器实现;恒容一般可采用钢制密闭反应器实现.
需指出,由于热效应的客观性,化学反应恒温的条件很难客观实现;敞口容器在实现恒压条件时,必然损害系统“封闭”的属性.
事实上,热力学恒温恒压或恒温恒容条件只能通过范特霍夫平衡箱实现,热力学过程均为准静态过程,这也是平衡态热力学最重要的特征之一.
2. 恒压热(Qp)与恒容热(QV)
恒压过程,Qp=ΔH (2)
恒容过程,QV=ΔU (3)
3. 恒容热(QV)与恒压热(Qp)的关系
恒容热(QV)与恒压热(Qp)的关系参见图1.
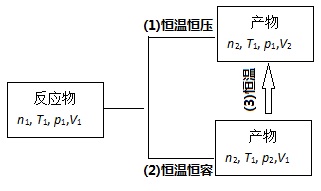
图1. 恒容热(QV)与恒压热(Qp)的关系
图1中过程(1), ΔH1=Qp, ΔH1=ΔU1+p1ΔV=ΔU1+p1(V2-V1);
图1中过程(2), ΔU2=QV, ΔH2=ΔU2+V1Δp=ΔU2+V1(p2-p1);
图1中过程(3), dU=T▪dS-p▪dV, dH=T▪dS+V▪dp;
另由能量守恒定律可得:ΔU1=ΔU2+ΔU3 (4)
ΔH1=ΔH2+ΔH3 (5)
3.1 化学反应产物均为理想气相物质
假设化学反应的产物均为理想气相物质,则恒温过程(3),ΔU3=0,ΔH3=0.
将上述结果分别代入式(4)及(5),并结合式(2)及(3)可得:
ΔU1=ΔU2=QV (6)
ΔH1=ΔH2=Qp (7)
Qp=QV+Σνi(g)▪RT (8)
备注:νi(g)代表化学反应中气相物质i的化学计量系数.
3.2 化学反应产物不全是理想气相物质
假设化学的产物不全是理想气相物质,则恒温过程(3),ΔU3≠0,ΔH3≠0.
将上述结果分别代入式(4)及(5)可得:
ΔU1≠ΔU2 (9)
ΔH1≠ΔH2 (10)
此时式(8)不成立, 即:Qp≠QV+Σνi(g)▪RT.
4. 结论
①化学反应恒温恒压的条件不能通过敞口反应器实现;
②化学反应恒温恒容的条件不能通过钢制密闭反应器实现;
③“Qp=QV+Σνi(g)▪RT ”成立的前提是化学反应的产物均为理想气相物质.
https://m.sciencenet.cn/blog-3474471-1329924.html
上一篇:克劳修斯不等式新解读
下一篇:热力学过程的自发性与可逆性辨析