博文
代谢学人——Cell Metabolism:雪旺招兵买马,"脂"为拯救细胞
||
代谢学人
Cell Metabolism:雪旺招兵买马,"脂"为拯救细胞
撰文 | 郑宇含 张婷 张彦康 仲银召 李雨
编辑 | 孟美瑶
校对 | 张婷

背景介绍
周围神经系统中的神经胶质细胞被称为雪旺细胞,沿神经元的突起分布,包裹在轴突外。其中,包裹大口径轴突的有髓鞘形成型雪旺细胞在轴突外形成髓鞘,另外无髓鞘形成型雪旺细胞包裹小口径轴突产生无髓轴突。雪旺细胞具有很强的可塑性,是周围神经损伤或病变后神经再生的关键。通常在神经损伤后,损伤部位远端轴突会发生Wallerian变性(周围神经损伤后发生的轴突坏死、髓鞘分解消失等一系列退行性变化),并产生残余的轴突和抑制神经生长的髓鞘碎片,而神经再生前则需要清除这些碎片。在损伤的神经中,雪旺细胞会发生适应性细胞重编程,成为具有修复能力的细胞,促进受损轴突的解体。随后,雪旺细胞通过髓鞘自噬、吞噬、吸引巨噬细胞等方式,协调清除髓鞘碎片。最后,雪旺细胞会促进轴突再生,并重建髓鞘。虽然在理想的实验条件下,雪旺细胞可有效修复神经损伤,然而在人类神经损伤后的临床结果上普遍效果很差,包括损伤部位对轴突生长的阻碍以及轴突生长速度相对缓慢等等问题。因此,神经损伤构成了重大的临床和经济负担。
一般而言,组织修复有很高的能量需求,这就需要调整局部细胞的代谢适应。在急性损伤后的神经修复中,雪旺细胞面临很大的代谢压力,需要协调分解代谢和合成代谢过程,从而实现受损神经的清除和再生。目前,雪旺细胞在神经修复过程中的代谢调节机制仍然是未知的。
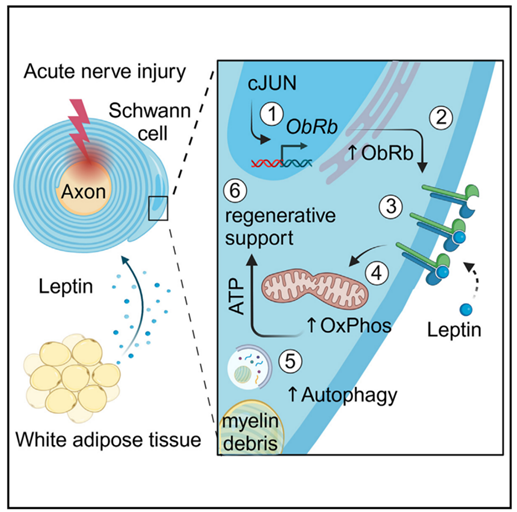
在本篇文章中,研究人员发现在神经修复过程中,雪旺细胞中线粒体氧化磷酸化水平上调,从而应对神经修复带来的代谢压力。此外,雪旺细胞接收脂肪细胞来源的瘦素信号,通过瘦素受体信号通路促进髓鞘自噬和线粒体呼吸,从而促进髓鞘再生和神经修复过程。总之,本文发现了急性神经损伤后脂肪细胞和雪旺细胞间的交流,这能有效调节神经损伤后的代谢稳态,为神经损伤修复开辟新的治疗方法。
敲黑板啦!
1.急性损伤后的神经修复过程与雪旺细胞瘦素受体信号有关
2.瘦素受体信号激活可促进损伤后神经胶质的代谢适应
3.脂肪组织来源的瘦素可激活雪旺细胞瘦素受体信号
研究结果
1.雪旺细胞线粒体响应神经受损
为了探究雪旺细胞在周围神经再生过程中的能量代谢反应,研究人员构建了坐骨神经损伤小鼠模型,并追踪4周内Wallerian变性、轴突再生、髓鞘再生以及雪旺细胞的自我修复反应,即在坐骨神经损伤1周时(1wpc),神经处于退行性变高峰期,在2wpc时退行性变仍存在,但轴突再生已经发生,髓鞘再生开始发生,在4wpc时轴突再生和髓鞘再生基本完成(图1A)。在坐骨神经损伤后,研究人员对整个神经内皮组织(包括雪旺细胞、轴突、和巨噬细胞)进行免疫组化和Western Blot分析,结果显示整个神经内皮组织中5种呼吸链复合物(CⅠ-CⅤ)表达均显著上调(图S1A-S1C)。为了探究坐骨神经损伤后雪旺细胞线粒体的变化,研究人员构建雪旺细胞特异性报告小鼠,可在雪旺细胞中特异性表达靶向线粒体膜的荧光蛋白Dendra2,结果显示坐骨神经损伤后,雪旺细胞线粒体水平显著增加,且在2wpc达到峰值(图1B-1D)。而脊髓运动神经元衍生轴突中线粒体水平在神经损伤前的基线水平较低,且在神经损伤后,Dendra2蛋白水平也无显著变化(图S1D-S1F)。接下来,为了进一步探究坐骨神经损伤后雪旺细胞中线粒体的变化,研究人员利用电镜和线粒体形态计量学分析发现,神经损伤2wpc和4wpc时雪旺细胞中线粒体变大(图1E);并且,与健康的坐骨神经内皮组织相比,神经损伤2wpc的内皮组织OCR水平显著升高,这与神经损伤后内皮组织线粒体水平升高有关(图1F)。
接下来,为了探究急性神经损伤调控线粒体代谢的机制,研究人员利用磷酸化蛋白探针阵列探究坐骨神经受损1wpc时调节雪旺细胞代谢的上游调控因子,该阵列分析显示神经受损时许多信号途径被显著诱导,包括细胞代谢调节相关途径(图2A-2B)。其中,瘦素水平在坐骨神经损伤1wpc时上调倍数最高,提示瘦素可能是雪旺细胞信号反应的调节因子(图2C),此时在坐骨神经损伤1wpc时,雪旺细胞处于髓鞘自噬的阶段,并能为轴突再生提供适宜的环境。有研究表明,瘦素是从脂肪细胞释放的循环细胞因子,在调节下丘脑食欲和饱腹感方面具有重要作用。且瘦素受体已被证明可介导多种组织的代谢过程,但其在雪旺细胞代谢中的调节功能仍不清楚。为了进一步探究瘦素信号在周围神经损伤中的潜在作用,研究人员检测了整个神经退行性变和再生过程中坐骨神经受损部位远端不同区域(包括神经外膜、神经束膜和神经内膜)中的瘦素(Lep)和瘦素受体(Lepr)的基因表达,结果显示坐骨神经受损后,Lepr基因在神经内膜中特异性高表达,且Lepr基因表达在神经损伤第3天开始上调,在第14天时表达量达到峰值(图2D)。此外,免疫组化结果进一步证明神经损伤诱导的神经内膜LEPR蛋白表达上调与雪旺细胞有关(图2E,S2A)。值得注意的是,瘦素受体基因可产生多种异构体,其中只有长Ob-Rb异构体具有与下游信号分子结合的完整的胞内结构域。因此,研究人员利用特异性BaseScope原位杂交证明了Lepr转录上调的产物是长Ob-Rb构型(图2F)。据报道,雪旺细胞的修复反应依赖于转录因子cJun的高表达。而特异性敲减雪旺细胞cJun基因可显著延缓急性神经损伤后的神经退行性变,并抑制神经再生。于是,为了探究雪旺细胞中Lepr表达上调是否依赖于损伤后cJun的高表达,研究人员构建了雪旺细胞特异性敲除cJun基因小鼠(cJun-cKO;图2G),发现神经损伤1wpc可诱导WT小鼠雪旺细胞中cJUN高表达和LEPR高表达,而敲除cJun后显著抑制了神经损伤1wpc后雪旺细胞中LEPR的基因和蛋白表达(图2H-I)。总之,这些结果表明神经损伤后雪旺细胞发挥修复作用,需要转录因子cJUN诱导Lepr表达。
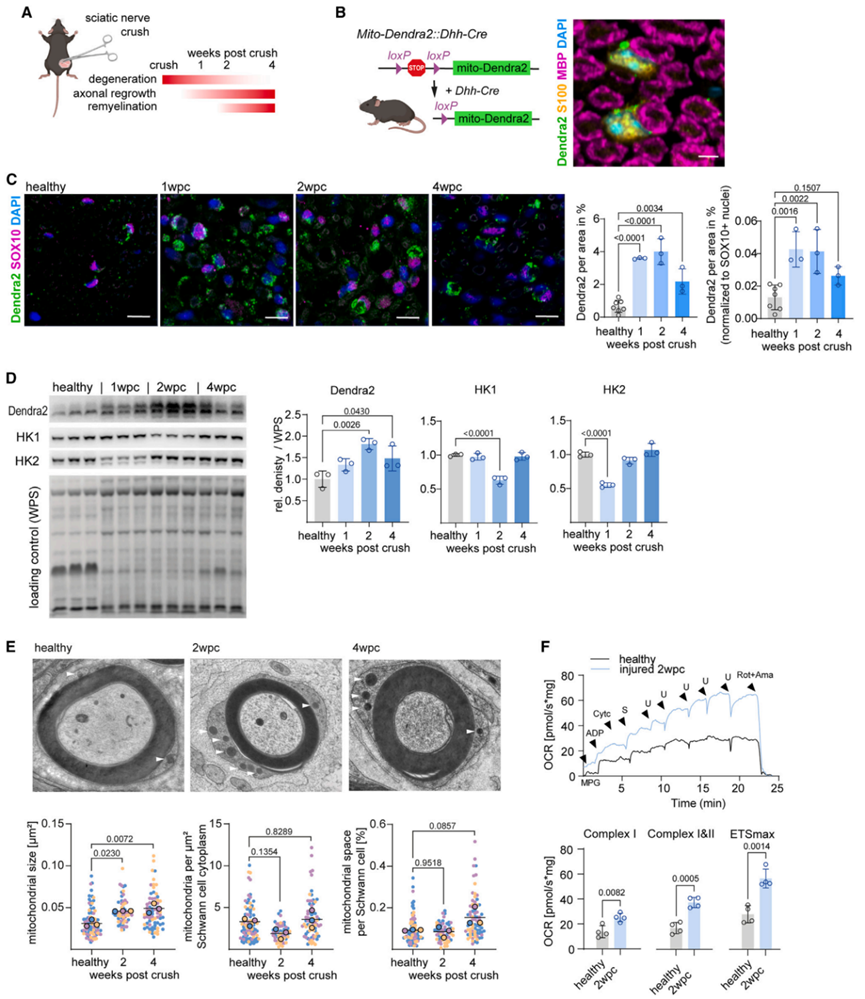
图1.周围神经损伤后雪旺细胞线粒体呼吸水平上调
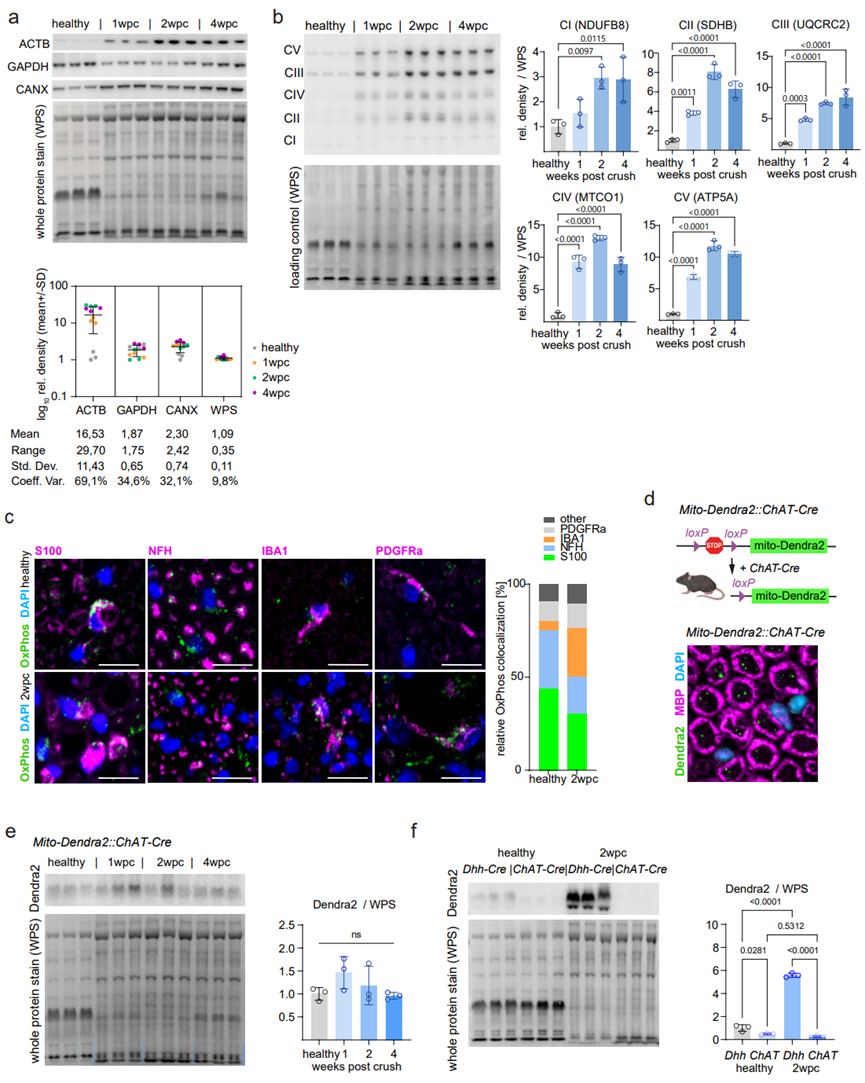
图S1. 受损神经中线粒体蛋白表达的动态调控
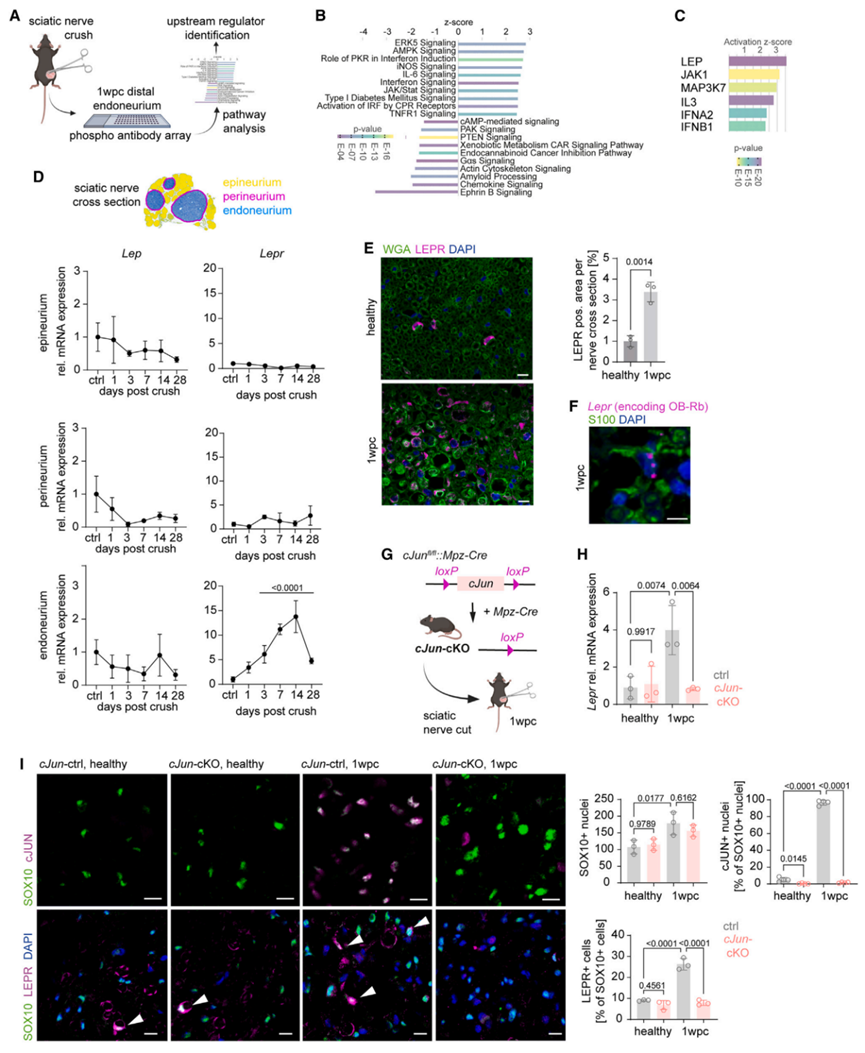
图2. 瘦素信号与受损神经的氧化磷酸化水平相一致
2.雪旺细胞中的瘦素受体信号促进神经再生
为了探究瘦素受体的表达与神经损伤后雪旺细胞代谢反应和神经修复功能有关,研究人员构建了雪旺细胞特异性敲除Lepr基因外显子1的突变小鼠(Lepr-cKO;图3A,S2C)。Lepr-cKO小鼠仍然能表达一个截短的瘦素受体,但没有信号肽,从而不能易位并暴露在细胞表面发挥功能。神经损伤后,WT小鼠雪旺细胞质膜上LEPR表达增加,且Leprot和Rnf41(调节LERP运输)的表达也显著上调,而Lepr-cKO小鼠雪旺细胞中LEPR膜易位明显受到了抑制(图3B,S2B),符合突变小鼠的遗传理论。与WT小鼠相比,健康的Lepr-cKO小鼠周围神经发育和未受损的成熟周围神经均没有明显变化(图3D-3F),因此可以利用Lepr-cKO小鼠研究雪旺细胞瘦素受体信号在神经再生过程中的功能。接下来,研究人员对WT和Lepr-cKO小鼠进行坐骨神经损伤,并通过数字步态分析追踪神经功能修复,发现在神经再生过程中,与WT小鼠相比,Lepr-cKO小鼠的神经功能显著受损(图3C)。同样的,与WT小鼠相比,Lepr-cKO小鼠在4wpc时(WT小鼠神经修复完成的时间点)复合肌肉动作电位(CAMP)较低(图3D),表明Lepr-cKO小鼠功能再生的轴突数量减少。此外,Lepr-cKO小鼠的神经传导速度(NCV,髓鞘再生的替代指标)也显著降低(图3D)。为了将这一现象与神经组织病理学相联系,研究人员对神经受损2wpc和4wpc的WT和Lepr-cKO小鼠坐骨神经进行电镜分析,并量化轴突再生和髓鞘再生,发现与WT小鼠相比,神经受损2wpc时Lepr-cKO小鼠总轴突数量显著减少,无髓鞘神经纤维数量显著下降,而有髓鞘神经纤维水平无明显变化(图S2D,3E),这表明Lepr-cKO小鼠轴突再生受损。值得注意的是,虽然在神经受损4wpc时Lepr-cKO小鼠的再生轴突总数恢复,但有髓鞘神经纤维水平显著减少,且髓鞘变薄(图S2D,3E-3F)。总之,这些结果表明,Lepr-cKO小鼠神经损伤后首先发生短暂的轴突再生受损,随后发生新生神经纤维的髓鞘再生受损。为了进一步探究Lepr-cKO小鼠神经损伤的修复机制,研究人员分析了神经损伤后巨噬细胞丰度和雪旺细胞特征变化,结果表明与WT小鼠相比,Lepr-cKO小鼠巨噬细胞数量无显著变化(图3E,S2E),但在2wpc时,Lepr-cKO小鼠再生神经中的雪旺细胞数量明显较少,同时雪旺细胞增殖率下降(图S2D,S2F)。然而,神经损伤后,Lepr-cKO小鼠雪旺细胞转分化和再分化相关基因的表达没有变化(图S2I)(小编注:在神经损伤后,雪旺细胞需要经历转分化(又称为适应性重编程阶段)与再分化促进神经修复,在转分化过程中,雪旺细胞在损伤部位增殖,通过髓鞘自噬、吞噬、招募巨噬细胞等方式,协调清除髓鞘碎片进行脱髓鞘。随后,雪旺细胞分泌神经生长因子促进轴突再生,并再分化为有髓鞘的雪旺细胞,重建髓鞘。因此,这些结果说明Lerp敲除抑制神经修复可能是由于减少了雪旺细胞的数量和增殖能力,但不影响雪旺细胞本身的转分化再分化能力)。研究人员发现,与对照组相比,Lepr-cKO小鼠中带有髓鞘卵形体(髓鞘退行性变特征)的雪旺细胞数量更多(图3E),表明Lepr-cKO小鼠的髓鞘碎片清除延迟。这一结果提示,周围神经修复过程中,Lepr-cKO小鼠雪旺细胞可能发生了髓鞘自噬受损现象。为了探究这一问题,研究人员检测了2wpc和4wpc的WT和Lepr-cKO小鼠坐骨神经的髓鞘自噬水平,结果显示在2wpc和4wpc时WT小鼠神经内膜的髓鞘自噬水平显著上调,而Lepr-cKO小鼠髓鞘自噬水平显著减弱(图3G,S2J)。有研究表明,敲除雪旺细胞Atg7基因以破坏细胞自噬途径,会延缓神经再生,但最终并不影响4wpc时的神经修复和髓鞘再生。因此,研究人员发现在4wpc时Lepr-cKO小鼠的髓鞘再生受损,这可能提示了瘦素信号在神经修复过程中可能发挥了更广泛的功能,不仅仅是髓鞘吞噬。
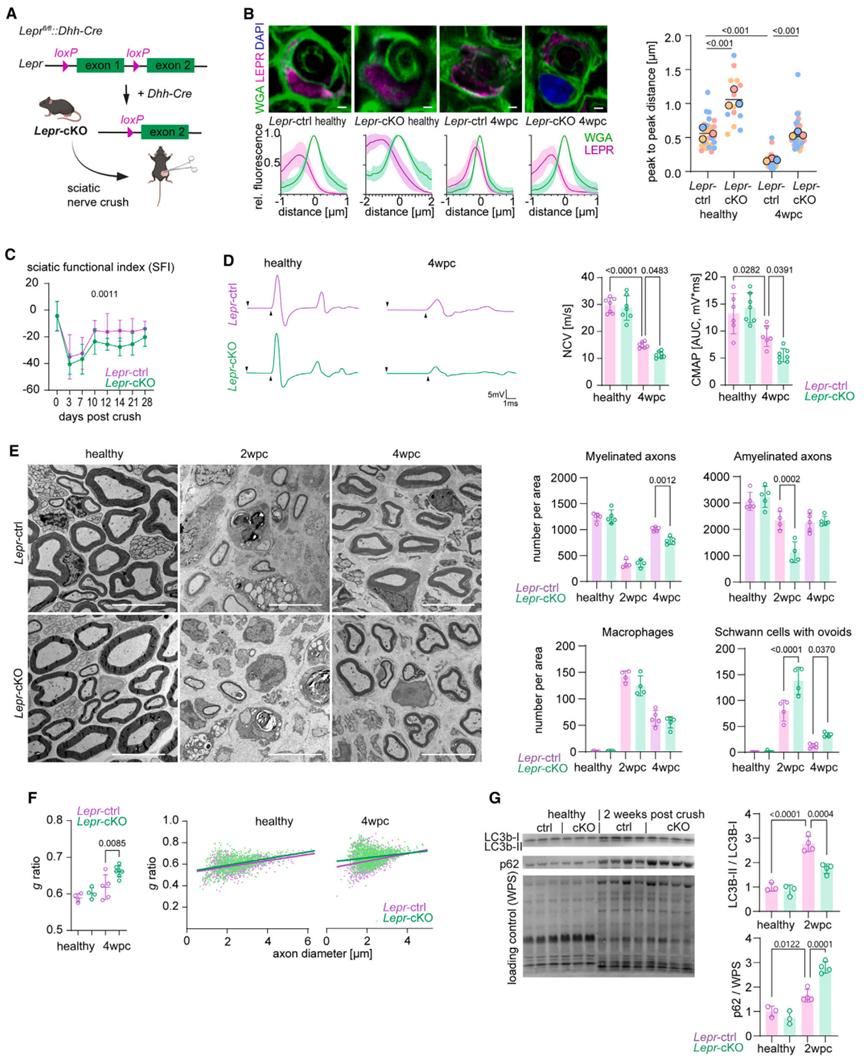
图3. 雪旺细胞特异性敲除Lepr基因对神经急性损伤后修复的影响
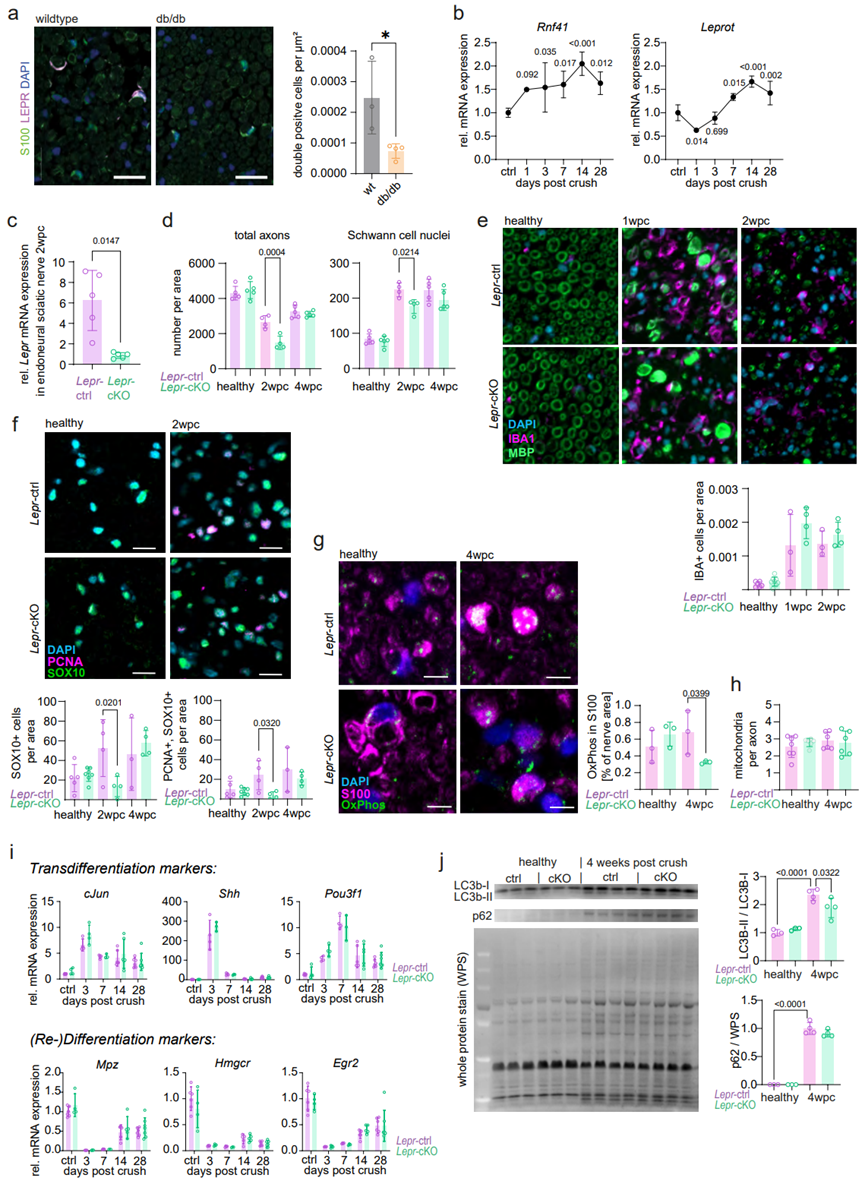
图S2. 雪旺细胞特异性敲除Lepr基因对神经修复的影响
3.瘦素受体信号在神经再生过程中调节线粒体呼吸
为了探究瘦素受体信号在雪旺细胞介导损伤修复中所发挥的其他功能,研究人员通过分析了已知的瘦素受体下游信号途径相关蛋白水平,发现与WT小鼠相比,神经损伤后的Lepr-cKO小鼠的神经内皮组织中PI3K/AKT,MEK/ERK和JAK/STAT信号明显受到抑制(图S3)。然而,磷酸化蛋白与组成型蛋白之间比例的下降大多是由于组成型蛋白表达水平升高,这可能是Lepr基因敲除所引起的继发机制。由于Western Blot实验是对神经内皮组织的全裂解物进行分析,无法确定发挥作用的具体细胞类型。接下来,研究人员对坐骨神经组织进行靶向pSTAT3的免疫组化分析(小编注:这里在坐骨神经组织中进行pSTAT3和SOX10的IF共染色,以SOX10为雪旺细胞Marker,统计pSTAT3和SOX10双阳细胞的数量,说明JAK/STAT信号通路在Lepr-cKO的雪旺细胞中被抑制),发现与WT小鼠相比,4wpc时Lepr-cKO小鼠坐骨神经组织中,pSTAT3阳性的雪旺细胞数量减少(图S4A),表明在神经损伤修复的后期阶段,瘦素受体信号主要调控JAK/STAT信号途径。随后,研究人员对2wpc和4wpc时的WT和Lepr-cKO小鼠的神经内膜组织进行RNA-seq,发现共有2300多个基因出现差异化表达,将这些差异基因按不同损伤修复时间调节轨迹,可分为3个模式:模式一:在2wpc和4wpc的Lepr cKO小鼠中下调的基因;模式二:在2wpc的Lepr cKO小鼠中下调,但在4wpc的Lepr cKO小鼠中上调的基因;模式三:在2wpc的Lepr cKO小鼠中上调,但在4wpc的Lepr cKO小鼠中下调的基因(图4A),其中与线粒体呼吸相关的基因在Lepr-cKO小鼠中显著下调(图4A)。随后,研究人员从MitoCarta中检索了所有氧化磷酸化(OxPhos)相关基因,发现在2wpc时,OxPhos相关基因在WT和Lepr-cKO小鼠中均表达上调;然而在4wpc的Lepr-cKO小鼠中OxPhos相关基因表达显著下调(图4B)。WB结果表明,4wpc时Lepr-cKO小鼠神经内膜中OxPhos相关蛋白(CⅢ、Ⅳ、Ⅴ)水平显著下降(图4C)。值得注意的是,RNA-seq和WB分析都是针对整个神经内膜,因此,2wpc时Lepr-cKO小鼠雪旺细胞线粒体基因表达的潜在变化可能被其他类型细胞的表达变化所掩盖。研究人员假设Lepr-cKO小鼠中线粒体相关基因和蛋白水平的变化是由雪旺细胞引起的,而4wpc的Lepr cKO小鼠雪旺细胞中OxPhos相关蛋白表达水平显著下降(图S2G),那么这一现象是否与所观察到的损伤后雪旺细胞线粒体形态变化有关(图1E),即线粒体变大?为了探究这一问题,研究人员再次利用电镜观察2wpc和4wpc时WT和Lepr cKO小鼠雪旺细胞线粒体形态,结果显示,与WT小鼠相比,Lepr cKO小鼠雪旺细胞内线粒体数量没有发生变化,而线粒体面积和雪旺细胞面积显著下降(图4D)。但损伤后Lepr cKO小鼠轴突线粒体数量没有明显差异(图S2H)。并且,4wpc时Lepr cKO小鼠神经内膜OCR水平显著下降(图4E)。总之,这些结果表明,瘦素受体信号介导的髓鞘自噬以及损伤相关的线粒体代谢反应与神经再生过程密切相关。为了探究神经受损后雪旺细胞中自噬和线粒体呼吸这两个分解代谢是否是偶联的,研究人员培养了坐骨神经外植体(一种离体神经变性模型),其包含整个神经内膜细胞,如雪旺细胞、成纤维细胞和驻留巨噬细胞,但排除了神经损伤后体液巨噬细胞的浸润(图5A)。接下来,研究人员首先探究了瘦素对髓鞘和轴突退行性变的影响。结果表明,当向培养基中加入重组瘦素时,髓鞘卵形体数量增加;而3-MA(自噬抑制剂)处理后显著抑制了髓鞘卵形体数量增加这一现象(图5B)。接下来,研究人员分析了神经外植体的自噬通量(即用氯化铵抑制溶酶体融合后检测LC3b-Ⅱ的积累量),结果发现瘦素处理可促进WT小鼠神经外植体中的自噬通量,但不影响Lepr-cKO小鼠神经外植体的自噬通量(图5C),这与神经损伤后Lepr-cKO小鼠的体内结果一致(图3G)。同样的,瘦素处理可显著促进WT小鼠神经外植体的基础和最大OCR水平,但不影响Lepr-cKO小鼠神经外植体的OCR水平(图5D-5E)。随后,为了评估受损神经中线粒体OxPhos对自噬激活的依赖性,研究人员用3-MA处理WT神经外植体,发现抑制自噬可显著降低受损神经的基础OCR,但不影响最大OCR;而在3-MA联合瘦素处理WT神经外植体,结果显示抑制自噬后瘦素处理不再影响WT神经外植体的基础OCR和最大OCR水平(图5D),这一结果表明,自噬可促进受损神经中的OxPhos水平,而瘦素信号可能通过部分促进雪旺细胞的自噬水平来调节线粒体呼吸。于是,研究人员假设线粒体呼吸和髓鞘自噬过程的偶联可以通过氧化髓鞘脂质来实现,而髓鞘脂质可以为OxPhos提供燃料。为了证明这一假设,研究人员用etomoxir(ETO,一种脂肪酸氧化抑制剂)处理神经外植体,单独用ETO处理不会影响神经外植体的基础或最大OxPhos,这可能是由于线粒体呼吸的底物可替代性。但ETO处理完全抑制了瘦素处理所诱导的基础和最大OCR水平上调这一现象(图5F)。总之,这些结果表明,周围神经损伤后,瘦素可以通过调节自噬和脂肪酸氧化以调节雪旺细胞的线粒体呼吸作用。接下来,为了研究JAK/STAT3与瘦素介导的代谢适应的关系,研究人员使用瘦素联合C188-9(STAT3特异性抑制剂)处理WT神经外植体,结果表明,抑制STAT3可以显著降低瘦素诱导的自噬和OCR水平(图S4B-S4C),这表明JAK/STAT3信号途径参与了受损神经中瘦素介导的代谢适应。然而在体内神经再生过程中,激活雪旺细胞中瘦素受体信号的瘦素来源仍是未知的。
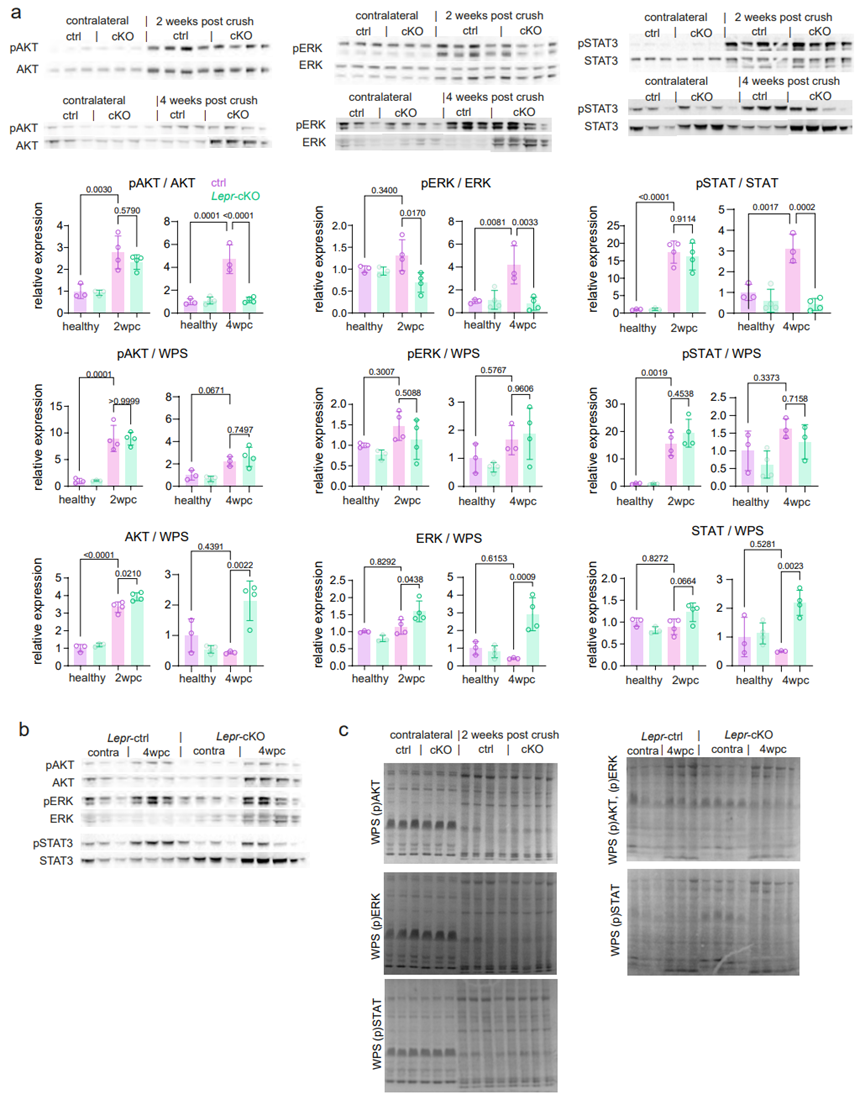
图S3. LEPR下游信号级联分析
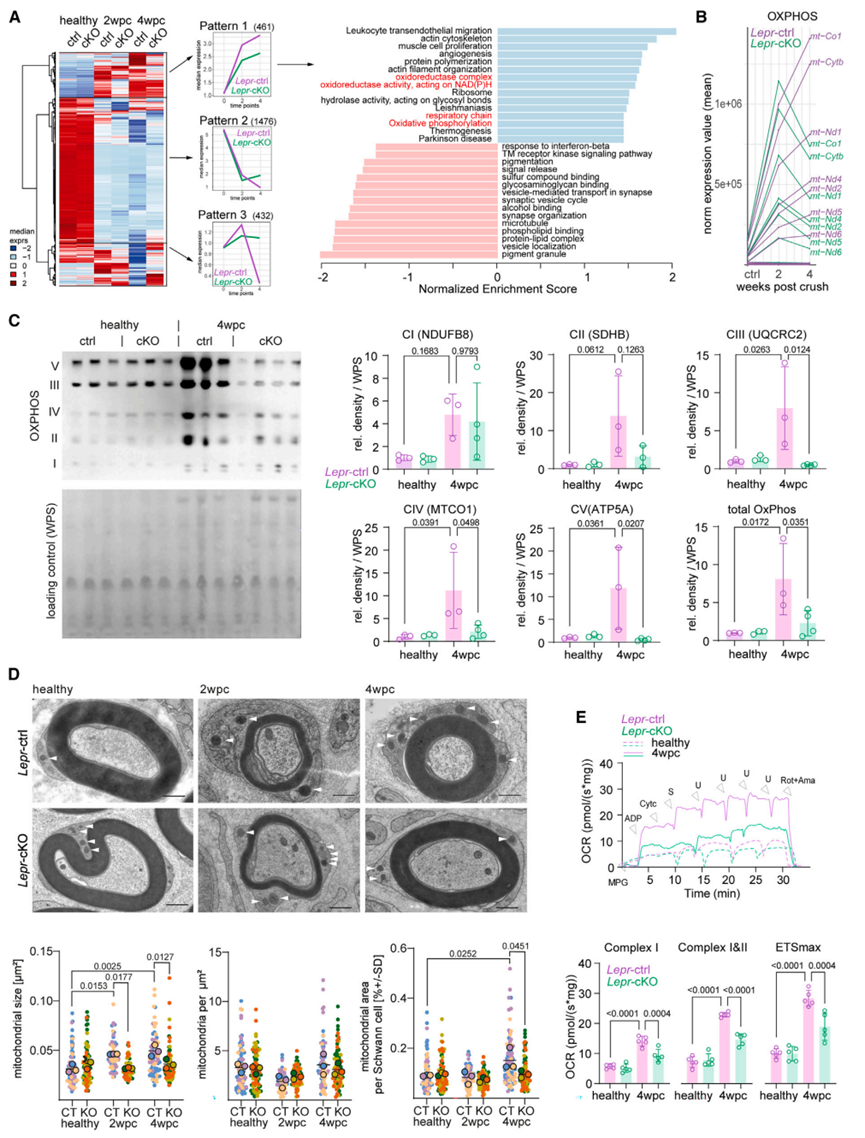
图4. 瘦素受体信号诱导髓鞘再生阶段雪旺细胞的线粒体呼吸
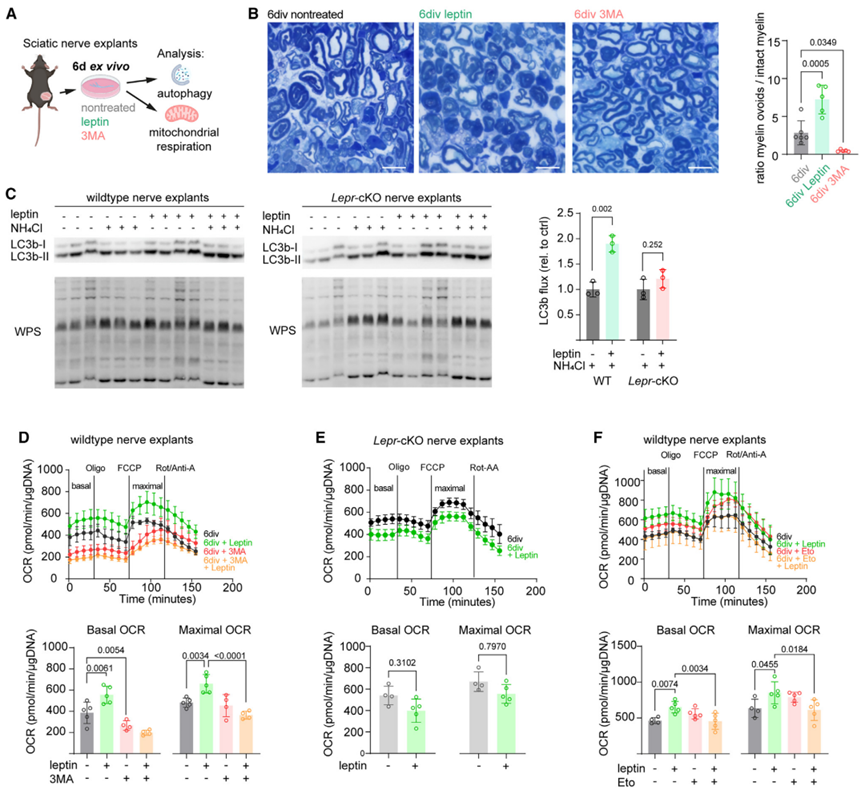
图5. 瘦素促进神经外植体自噬和线粒体呼吸
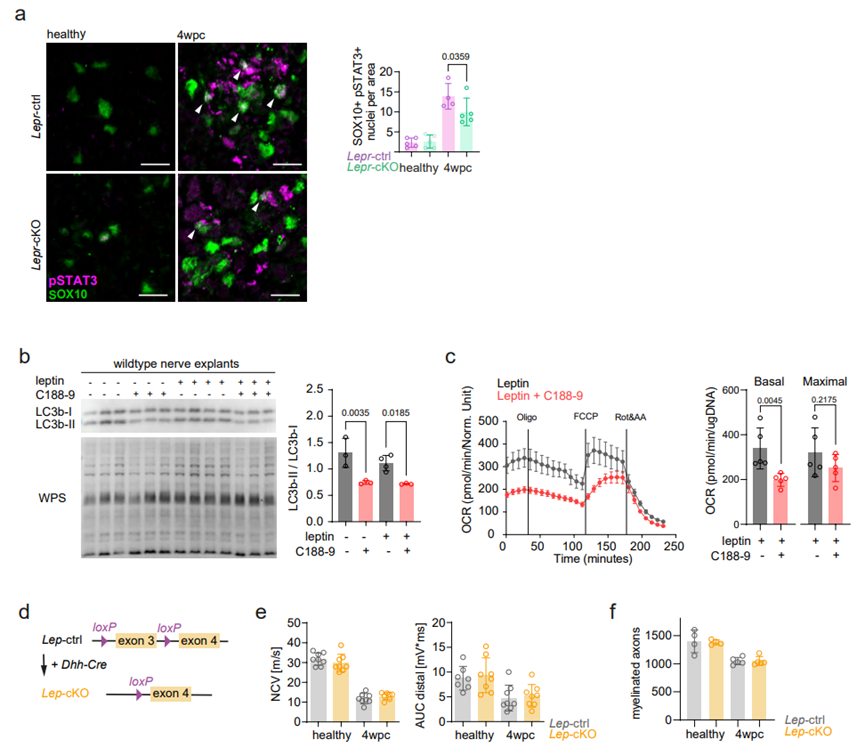
图S4. STAT3在瘦素信号下游的作用
4.脂肪细胞来源的瘦素促进神经再生
尽管神经损伤并没有调控雪旺细胞中瘦素的基因表达(图2D),但原位杂交结果显示神经损伤1wpc后雪旺细胞中有少量的瘦素mRNA表达(图6A)。因此,为了探究神经受损后雪旺细胞是否受到了自身产生的瘦素刺激,研究人员构建了雪旺细胞特异性敲除Lep基因小鼠(Lep cKO),结果显示雪旺细胞特异性敲除Lep基因后,并不影响神经损伤修复(图S4D-S4F)。
先前研究表明,血液中瘦素主要来源于脂肪细胞。BaseScope原位杂交发现神经外膜周围的脂肪组织中高表达瘦素蛋白,且在神经损伤修复过程中,神经外膜周围的白色脂肪组织中瘦素蛋白水平显著增加(图6A-6B)。据报道,瘦素水平与脂肪组织质量密切相关,提示周围神经损伤可能调控了脂肪组织质量。为了验证这一假设,研究人员检测了坐骨神经周围脂肪组织质量,发现在周围神经损伤修复过程中,神经周围脂肪组织质量显著增加(图6C),这表明神经损伤可能通过促进脂肪细胞分泌瘦素,作用于神经胶质的瘦素受体,进而调节雪旺细胞代谢,促进神经损伤修复。为了进一步验证这一结论,研究人员构建了脂肪组织特异性敲除Lep基因的ERT2小鼠(Lep-AcKO,图6D-6F),在小鼠2月龄时给予他莫昔芬治疗3天以敲除Lep基因,再经过2周休息期以消耗小鼠体内剩余的瘦素(图6E)。随后研究人员诱导WT小鼠和Lep-AcKO小鼠的坐骨神经损伤,4wpc后,Lep-AcKO小鼠的神经周围脂肪组织瘦素的基因和蛋白表达显著下降(图6F-6G)。虽然脂肪细胞特异性敲除Lep基因可能会引发全身代谢变化,但是Lep-AcKO小鼠仅表现出轻微的体重增加,且糖稳态无明显变化(图S5A-S5B)。值得注意的是,与WT小鼠相比,神经损伤后Lep-AcKO小鼠的神经功能恢复能力受损,与Lepr-cKO小鼠类似(图6H-6I;图3C-3D),且神经损伤过程中,Lep-AcKO小鼠轴突再生受损,雪旺细胞数量和增殖能力并无明显变化,但2wpc时具有髓鞘卵形体的雪旺细胞数量显著增多,同时自噬水平显著下降(图6J,S5C-S5E)。此外,与Lepr-cKO小鼠相似,4wpc时Lep-AcKO小鼠髓鞘再生受损,髓鞘更薄(图6J-6K)(小编注:本文主要研究的是腘窝部位的脂肪组织,位于膝关节后方,在坐骨神经周围。坐骨神经周围存在脂肪,本文研究发现坐骨神经损伤后,腘窝脂肪质量增加且瘦素蛋白水平增加)。
并且,与WT小鼠相比,4wpc时Lep-AcKO小鼠的神经内膜组织线粒体呼吸能力显著受损,雪旺细胞中OxPhos相关蛋白水平下降(图6L,S5F-S5G)。总之,这些结果表明,脂肪细胞释放的瘦素水平可调控周围神经损伤修复过程。
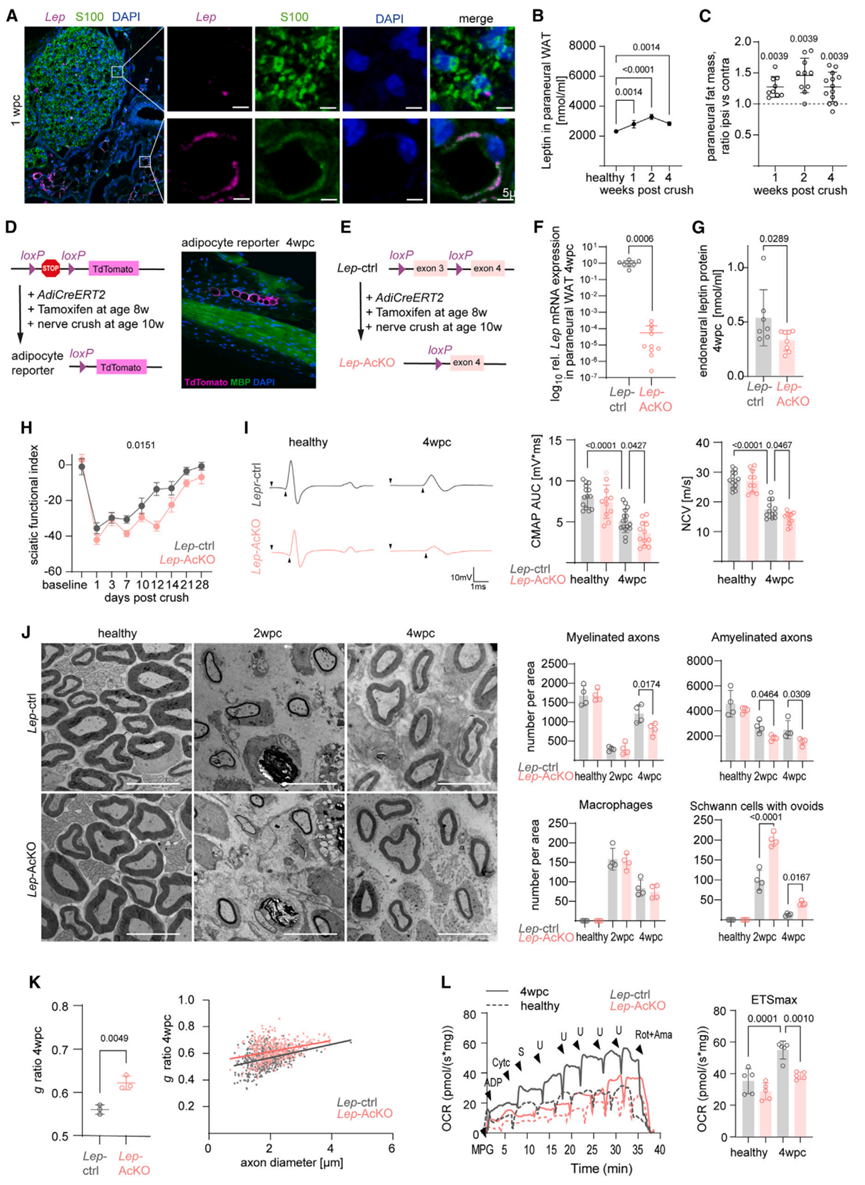
图6. 神经修复需要脂肪细胞来源的瘦素
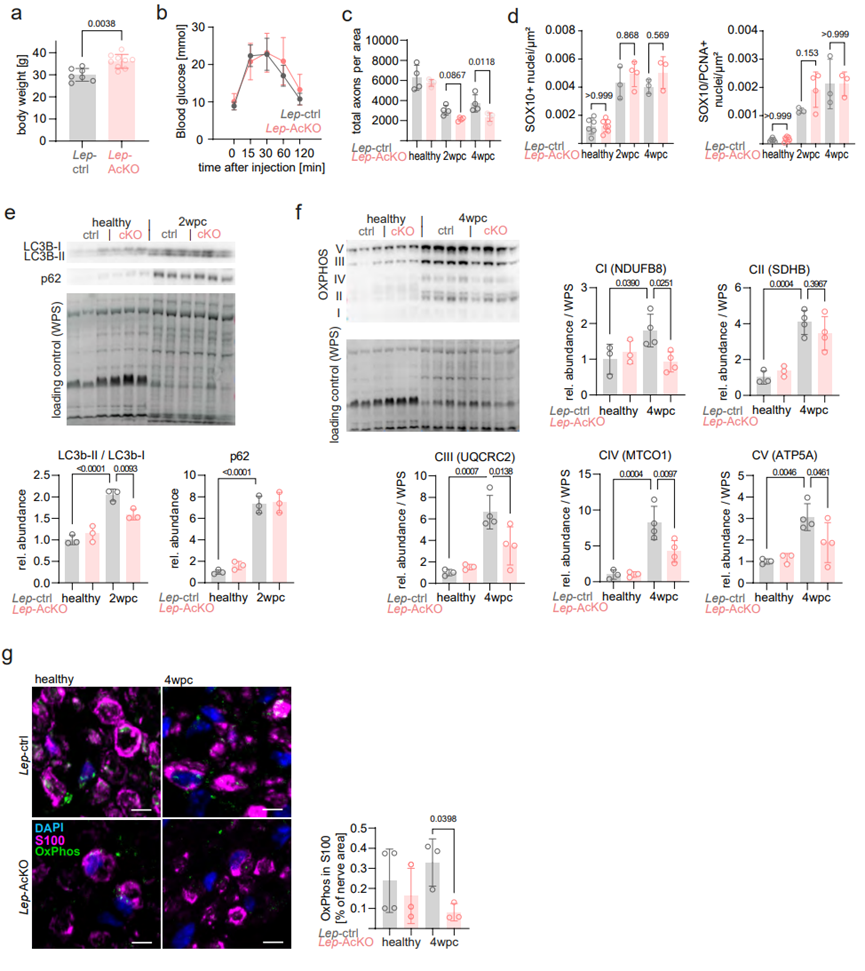
图S5. 脂肪细胞敲减瘦素会抑制神经修复
5.瘦素治疗可促进急性神经损伤后修复过程
为了探究靶向脂肪-神经瘦素信号轴是否促进神经损伤后修复过程,研究人员进行了一项三臂治疗试验:在神经损伤后的前2周向小鼠皮下注射瘦素(lep)或载体(veh),随后2周再给小鼠皮下注射瘦素或载体,形成3组:(1)veh/veh;(2)lep/veh;(3)lep/lep(图7A)。连续4周瘦素治疗显著提高了4wpc小鼠血液和神经内膜的瘦素水平(图7B)。且两组接受lep治疗的小鼠(lep/veh和lep/lep)神经受损后其神经功能修复水平显著升高,并促进髓鞘再生(图7C-7E)。总之,这些结果表明,瘦素治疗可作为提高急性神经损伤修复能力的有效治疗方法。
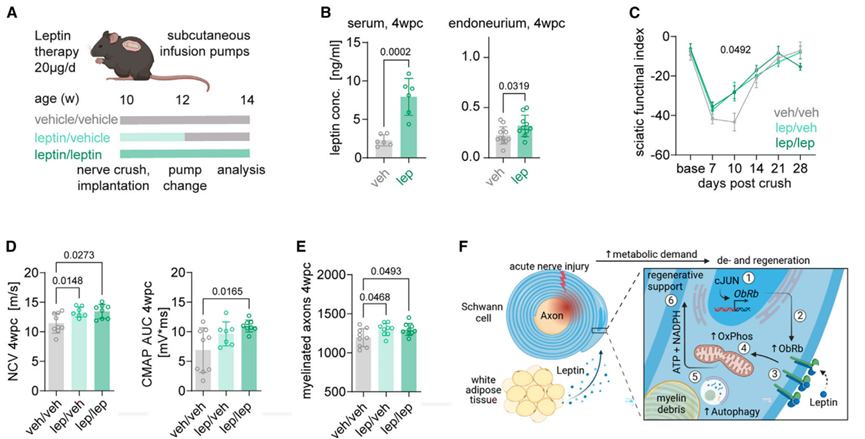
图7. 瘦素治疗促进受损周围神经的再生
总结
本文中,研究人员发现神经损伤可诱导脂肪细胞向神经胶质细胞传递信号,以促进神经损伤后的再生修复过程,并确定了脂肪因子瘦素是调控神经修复过程中胶质细胞代谢的上游调节因子。进一步研究发现,脂肪来源的瘦素作用于雪旺细胞瘦素受体,通过调节雪旺细胞的自噬和线粒体呼吸作用,以维持周围神经损伤后修复能力。总之,该研究结果表明急性神经损伤可触发脂肪-神经胶质细胞间的交流,进而调节神经胶质代谢,为神经修复提供足够的能量。
原文链接:https://www.cell.com/cell-metabolism/fulltext/S1550-4131(23)00386-8
关注微信公众号代谢学人
了解更多代谢前沿资讯

https://m.sciencenet.cn/blog-3483272-1414784.html
上一篇:Nature Metabolism: 肥胖可意会,亦可“炎”传
下一篇:代谢学人--Science:核糖体“躺平”引发的代谢危机