博文
微型机器人运送药物
|
微型机器人运送药物
超过90%的候选药物在临床试验中失败。失败的原因有很多,包括缺乏功效、材料性能差和缺乏商业需求。值得注意的是,大约30%的候选药物由于无法控制的毒性而未能通过临床试验,这通常是由大多数药物所需的全身给药方法引起的(1)。如果这种无法控制的毒性可以得到改善,至少对于其中一些药物,通过确保它们精确地输送到疾病部位而不是整个身体,会怎样?这就是微型机器人的前景——通过载货微型机器进行物理靶向治疗。微型机器人的潜在应用可以允许重新考虑因毒性而被放弃的药物,并鼓励药物开发人员寻求新的化学物质。
Delivering drugs with microrobots | Science
创造微型机器人的主要动机是克服药物在全身扩散的局限性,微型机器人是几纳米到亚毫米大小的小型设备,可以从体液和组织推进到指定位置。缓慢的扩散速率代表了微生物在发展其运动策略时所响应的相同进化压力。草履虫纤毛表现出的动力冲程,真核鞭毛(如精子尾巴)的行波,以及鞭毛细菌(如大肠杆菌)进化出的迷人的旋转马达,都有助于这些微生物向环境中更有利于生存的位置移动(2).这些运动策略解决了由于在小尺度上占主导地位的截然不同的物理特性而存在的深刻工程挑战。因此,迄今为止创造的许多微型机器人都受到运动微生物的启发,例如布氏锥虫(Trypanosoma brucei)和大肠杆菌(3)。微型机器人不是为了延长存活率和帮助确保繁殖而移动到疾病源,而是被设计成移动到疾病源,例如血流阻断血栓或恶性肿瘤,然后它们可以释放具有剧毒但局部治疗效果的药物。
微型机器人的潜在医疗程序
导管或内窥镜将微型机器人输送到正在治疗的身体区域,例如肿瘤或血凝块。微型机器人组件被部署到脉管系统中,并导航到目标。微型机器人拆卸,释放治疗剂。然后,微型机器人被降解,要么被吸收,要么从体内清除。
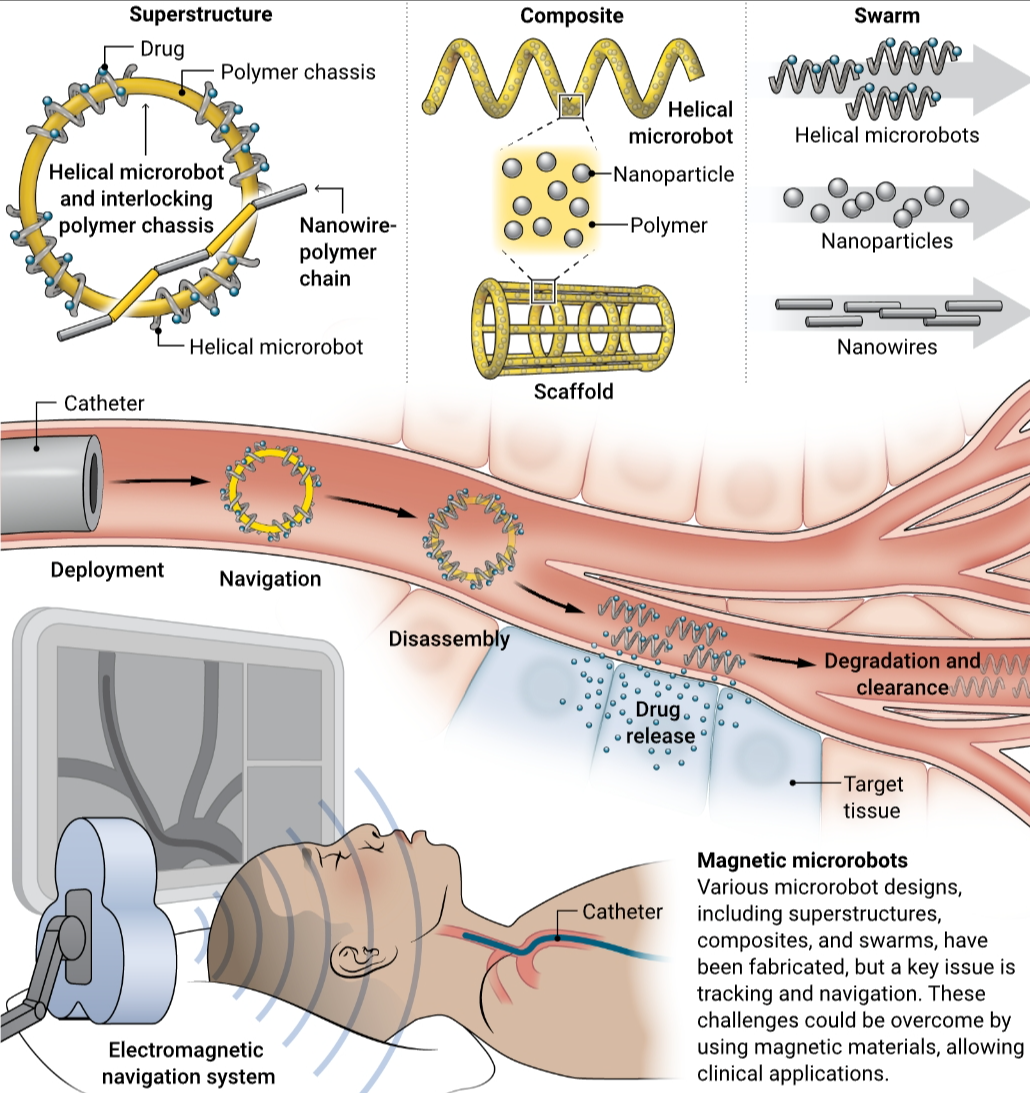
在过去的20年中,变形软材料的进展促使微型机器人专家设计和制造使用复杂推进机制的运动装置。这些例子包括可以滑过表面以收获生物材料的弹簧质量系统,具有柔性关节的基于纳米丝的电机,可复制鞭毛在精子上的起伏推进,以及模仿蠕虫蠕动运动的光诱导运动 (4)。还开发了更先进的车辆,例如微型汽车、微型船和五足蜘蛛,它们都由互锁的聚合物金属微结构组成 (5)。随着体内研究的不断增加,运输货物和递送疗法的方法已经被设计出来,包括应用趋磁细菌作为微型机器人平台,将载药脂质体运输到小鼠肿瘤中 (6)。此外,磁共振成像 (MRI) 可追踪的多功能微型机器人已被开发用于治疗肝癌并在大鼠中进行了测试 (7),并且能够在腹膜腔内递送干细胞的微型机器人已在小鼠模型中进行了测试 (8)。这些临床前研究表明,微型机器人可以在体内导航并提供局部治疗;首次人体试验只是时间问题。
在体液和组织中推动微型机器人是一项关键挑战。大量的研究都致力于化学推进,它依赖于设备表面反应产生的化学梯度。这些系统在体内的使用具有挑战性,因为控制轨迹的局限性以及需要适当浓度的适当燃料。对于运动控制不太相关的疗法,设备已显示出体内应用的潜力,例如啮齿动物膀胱内的酶促纳米马达 (9)。推进的另一种可能性是使用外部能源为小型结构提供运动(10)。光可以通过传递动量或诱导光催化反应来推动小型设备。然而,光对组织的渗透通常是有限的。一种更实用的体内微器件驱动策略需要使用超声波,因为这种方法在很宽的频率范围内显示出生物相容性。最近,超声被用于捕获和导航小鼠毛细血管内的微观结构 (11)。然而,这种方法也面临着一些挑战,例如导航能力有限和身体组织对超声波的吸收。
至少在短期内,外部产生的磁场可能是人体内小规模结构导航和驱动的最可行选择。磁场为微型机器人提供了多种运动策略 (11)。不同的方法基于结构设计和所用磁场的类型,例如磁场梯度和振荡或旋转磁场。磁场还可以与其他推进方法相结合,以提高导航性和控制性,并触发微型机器人的其他功能,如变形、加热和磁电。例如,形状转换可用于优化导航或组织相互作用。磁场可以诱发磁性微型机器人的热疗,这可以作为肿瘤消融的有效途径。将磁电材料结合到微型机器人中,通过外部磁场刺激产生局部电场。这些电场激活钙通道,可以刺激和修复神经系统、软骨或骨骼中的受损组织 (12)。
一个重要的挑战是装置推进所需的核心磁性材料。迄今为止报道的许多磁性微型机器人都包含生物相容性较差的材料,例如镍、钴和钕基金属和合金。最有希望的候选者是铁(6),它是唯一同时表现出出色饱和磁化强度的磁性元素,这是材料在受到增加的磁场时可以表现出的最大磁响应,并且细胞毒性相对较低。铁的一个可能问题是其耐腐蚀性差,这一特性对可生物降解的微型机器人很有吸引力,但在小规模上却带来了巨大的制造挑战。因此,生物相容性磁性材料的其余选择包括铁基合金和铁基氧化物。铁基合金,如铁铂 (FePt) 纳米磁体,在癌细胞中转染 DNA 质粒方面显示出前景 (13)。然而,为了保持FePt的硬磁特性,必须将其加工成适合体间隙(直径小于10nm)的特定化学计量。基于氧化铁的纳米颗粒似乎是生物医学微型机器人的一个不错的选择,因为它们可以以可清除的尺寸进行加工,并且它们的饱和磁化强度和矫顽力(对磁场的响应性)可以广泛定制。
植入后的微型机器人跟踪也很重要。在医学成像技术中,X 射线计算机断层扫描 (CT) 和 MRI 分别显示出 1000 和 500 μm 的最高空间分辨率。这意味着单个微型机器人的体内成像是困难的。然而,单个微型机器人不太可能完成治疗任务;设想了将治疗有效载荷输送到组织的微型机器人的集群、上部结构组件或聚合物复合材料。最现实的程序是将这些药物注射到足够多的组中,以便通过传统的医学成像技术进行跟踪。最好使设备在体内无害降解,而不是需要移除。最近,已经设计了由聚合物复合材料体组成的微型机器人,这些聚合物复合体可以通过pH或酶消化等机制进行降解。此外,它们的化学结构可以被编程为缓慢溶解并被身体清除 (14)。随着增材微制造(例如双光子聚合)的最新进展,可以创建复杂的设计。这些微型机器人中的许多都使用引起炎症或细胞毒性的光敏化学物质。正在进行的工作旨在为微型机器人生产创造高分辨率的生物惰性墨水(15),这些墨水是合成的或基于动物的。
仍然存在两个重要问题。需要多少个微型机器人才能将治疗剂量的药物输送到目标组织?如何使用这些设备进行医疗程序?磁性微型机器人在体内的运动性能越来越受到研究,特别是在血管系统中,对磁场特性的要求也越来越明确。然而,在每秒几段身体长度(即∼100μm/s)的速度下,微型机器人可能需要长达3个小时才能从手臂(注射点)到大脑(∼1m)。对于许多应用来说,这个时间尺度太长了,例如中风治疗。因此,可以使用导管或内窥镜。这些设备具有高度的灵巧性和灵活性,可以快速穿过脉管系统,因此它们可以在目标附近运送微型机器人。部署的微型机器人可以随血流或逆血流移动,或者血流可以短暂中断,使它们能够畅通无阻地游到脉管系统更深处的位置(见图)。例如,通过将溶栓剂精确地输送到大脑中难以触及的血管,可以通过使用微型机器人治疗中风来克服与这些药物相关的出血和副作用的全身风险。
磁导航系统产生必要的磁场和磁场梯度以引导人体中的微型机器人,是实现医疗程序的关键组成部分。这些系统将放置在患者附近,因此它们必须与临床环境兼容,并在建筑基础设施和医学成像技术方面轻松与医疗保健设施集成。它们也不应对患者和临床医生构成风险。正在考虑中的许多系统都是基于移动永磁体的。这些磁铁无法关闭,因此可能变得危险,因为它们会对磁性医疗工具施加力。基于永磁体的系统在多功能性和有限的动态响应方面也受到限制。相比之下,电磁导航系统可以产生快速变化的复杂场和场梯度来操纵机器人。例如,Navion由一个相对紧凑的电磁系统组成,使其易于在整个诊所中运输,可集成到标准手术室中,并适用于商业透视和CT系统。目前正在大型动物模型中进行使用磁性机器人导管进行诊断性脑血管造影的体内试验,证明人类规模的导航是可能的。
获得监管部门的批准是将微型机器人技术整合到临床中的主要障碍。从器械概念开始就必须考虑监管障碍,包括广泛的生物相容性和药效学研究,以彻底了解可能的副作用。与临床医生合作也是了解治疗程序(即手术工作流程、所需医疗设备、灭菌程序)和医疗保健设施复杂性(即手术室空间、成像、可用的训练有素的人员)的关键。换句话说,创新必须与临床需求和现实世界的医疗保健实践保持一致。仅从工程角度想象程序可能会导致从业者因不必要的复杂性而拒绝。重要的是要关注简单性,至少在将微型机器人从实验室转移到诊所的第一次尝试中是这样。
RE FERENCES
1.D. Sun, W. Gao, H. Hu, S. Zhou, Acta Pharm. Sin. B12, 3049 (2022).
2.H. C. Berg, Phys. Today53, 24 (2000).
3. H. W. Huang, M. S. Sakar, A. J. Petruska, S. Pané, B. J. Nelson, Nat. Commun.7, 12263 (2016).
4. C. Hu, S. Pané, B. J. Nelson, Annu. Rev. Control. Robot. Auton. Syst. 1, 53 (2018).
5. C. C. J. Alcântara et al., Nat. Commun. 11, 5957 (2020).
6. O. Felfoul et al., Nat. Nanotechnol. 11, 941 (2016).
7. G. Go et al., S c i . A d v. 8, eabq8545 (2022).
8. S. Jeon et al., Sci. Robot. 4, eaav4317 (2019).
9. A. C. Hortelao et al., Sci. Robot. 6, eabd2823 (2021).
10. J. Li, B. Esteban-Fernández de Ávila, W. Gao, L. Zhang, J. Wang, Sci. Robot. 2, eaam6431 (2017).
11.W. C. Lo, C.-H. Fan, Y.-J. Ho, C.-W. Lin, C.-K. Yeh, Proc. Natl. Acad. Sci. U.S.A. 118, e2023188118 (2021).
12.M. Dong et al., Adv. Funct. Mater. 30, 1910323 (2020).
13.V. M. Kadiri et al., Adv. Mater. 32, 2001114 (2020).
14.J. Llacer-Wintle et al., Adv. Mater. 33, 2102049 (2021).
15.M. Falandt et al., Adv. Mater. Technol.8, 2300026 (2023).
https://m.sciencenet.cn/blog-41174-1413330.html
上一篇:氢气临床研究进展【挪威】
下一篇:“超高产”作者数量激增令科学家担忧