博文
氢气对线粒体保护的研究
||
线粒体是细胞内能量代谢的枢纽,线粒体功能障碍和许多疾病的发生发展有关,线粒体也是细胞内活性氧产生的重要部位,当线粒体功能异常时活性氧产生过量,可以导致细胞损伤甚至细胞死亡,各种细胞线粒体异常和氧化损伤导致相应疾病。线粒体被认为起源于一种古老细菌,这些细菌具有代谢氢气的潜力,因此线粒体也非常有可能会受到氢气的影响。氢气治疗疾病可能和氢气影响来自线粒体氧化应激被阻断有关。因此关于氢气和线粒体功能保护的研究,也成为氢气医学领域的重要方向。本文氢气对线粒体保护研究前景内容来自最新《氢气在疾病健康中作用》新书第三章的内容,全文内容见氢思语。
摘要 线粒体源自于内共生的好氧细菌。通过这种共生,真核生物获得了一种高效的能量产生系统,但代价是暴露于活性氧物质(ROS)引起的氧化应激。氢气(H2)是最近被确认为一种抗氧化剂,它能选择性地减少ROS,例如羟基自由基和过氧化亚硝酸盐,这些都是强氧化剂,其临床应用也在进展中。
本文总结了H2在实验模型和几种人类慢性炎症性疾病上的疗效研究,证明氢气通过保护线粒体功能来发挥作用。H2的保护作用可能是通过调节线粒体ROS来实现的。由于许多常见疾病,如代谢病和神经退行性疾病,都检测到了线粒体功能障碍,因此开发保护或激活线粒体功能的技术和方法将对未来医学的发展是必要的。由于H2对线粒体功能的影响,它可能被视为未来医学的一个候选物。

前言
大约20亿年前,当古菌吞噬了好氧细菌——变形菌时,真核生物出现,它们获得了一个高效的能量产生系统,但代价是暴露于线粒体产生的活性氧物质(ROS)所引起的氧化应激[1]。抗氧化酶对ROS的产生无效,例如羟基自由基(·OH)和过氧化亚硝酸盐(ONOO–),这些是非常强的氧化剂[2, 3]。
分子氢(H2)最近被确认为一种直接还原·OH和ONOO–的抗氧化剂[4]。H2还通过调节基因表达发挥间接的抗氧化、抗炎和抗凋亡效应[5,6,7]。其他H2发挥效果的间接机制也有报道,例如细胞中的核因子相关因子2(Nrf-2)和各种信号通路[8,9,10]。关于H2生物学效应的研究总数现在超过1600项[11]。其中,关于人类临床试验的研究超过120项。由于在人类临床研究中未观察到H2的副作用,因此正在进行各种临床研究以调查其对各种病理状况的改善效果[11]。
认为保护线粒体功能可能在H2对抗与氧化应激相关疾病的疗效中起作用。在这项研究中,我们将检验H2在实验疾病模型以及包括2019年冠状病毒感染病后遗症(COVID-19)和慢性疲劳综合症/慢性疲劳综合症(ME/CFS)在内的慢性炎症性疾病中的疗效。此外,我们讨论了H2改善这些疾病的机制及其在未来医学中的潜力。
氧化应激调节健康与疾病
ROS的产生和清除系统
氧气约占空气的20%,对于呼吸生物的能量生产至关重要[2, 3, 12]。氧气进入体内后,被细胞中的线粒体用来产生三磷酸腺苷(ATP)。然而,消耗的氧气中有1-2%变成了ROS,这些是体内的强氧化剂[2, 3, 12]。人体配备了抗氧化酶作为防御机制以抑制ROS的产生。抗氧化酶包括超氧化物歧化酶(SOD)、过氧化氢酶和谷胱甘肽过氧化物酶(图3.1)。
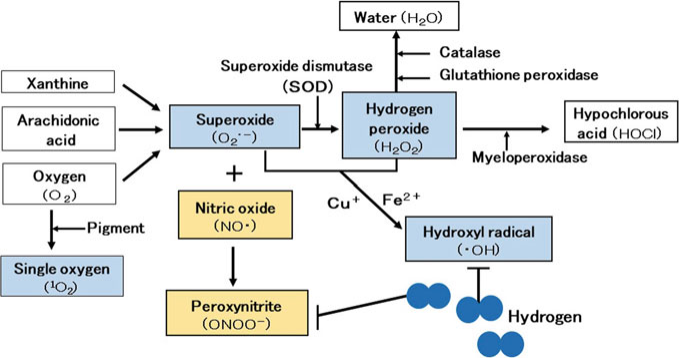
图 3.1 ROS的产生和清除系统。氢气可选择性地清除羟基自由基和ONOO-。
抗氧化酶,如SOD、过氧化氢酶和谷胱甘肽过氧化物酶,不能清除羟基自由基或ONOO-两种强氧化剂。
在人体中有四种主要的活性氧物质(ROS):超氧阴离子、过氧化氢、羟基自由基(·OH)和单线态氧[2, 3, 12]。单线态氧是在紫外线照射下,体内的色素作为敏化剂与氧发生反应产生的。当电子从线粒体呼吸链泄漏并与氧结合时,会形成超氧阴离子[12]。此外,超氧阴离子不仅由氧和黄嘌呤氧化酶使用黄嘌呤作为底物产生,还可以通过血管内皮细胞中的花生四烯酸级联反应产生。超氧阴离子是一种相对活泼的物质,但会被超氧化物歧化酶(SOD)分解成过氧化氢[12]。然后,过氧化氢被过氧化氢酶和谷胱甘肽过氧化物酶分解成水和氧,并在体内解毒[12](图3.1)。
随着年龄的增长,抗氧化酶的功能和身体对抗氧化物质的防御能力下降[2, 3]。此外,当由于过度运动、精神和身体压力、吸烟、饮酒、暴露于紫外线和辐射、空气污染等原因产生大量ROS时,ROS的产生和清除系统之间的平衡被打破,导致出现的ROS超出抗氧化酶的防御能力,最终导致细胞和基因损伤[2, 3]。
当氧化和抗氧化之间的平衡被打破时,超氧阴离子和过氧化氢会在铁和铜离子的催化下产生·OH,这是一种非常强的氧化剂[2, 3, 12]。·OH还可以通过其他生物反应产生,以及当水这种生物物质暴露于辐射时[2, 3, 12]。另一方面,一氧化氮会产生ONOO–,另一种非常强的氧化剂(图3.1)。尽管·OH在体内只存在百万分之一秒,但在那段时间内,它展现出的氧化能力比超氧阴离子强100倍[13]。
因此,当·OH和ONOO–产生时,它们会与生物体的膜和组织中的核酸、脂质和蛋白质发生反应,造成氧化损伤[2, 3]。它们还会氧化控制遗传信息的DNA。然而,超氧阴离子和过氧化氢没有足够的氧化能力直接氧化DNA。DNA的氧化导致遗传损伤,进而诱发生活方式相关的疾病,如癌症[2, 3, 12]。抗氧化酶不能解毒·OH或ONOO–。相比之下,H2选择性地清除大量的·OH和ONOO–,并将它们转化为水(图3.1)。例如,H2和·OH之间的化学反应方程式如下:⋅OH+H2→H⋅+H2O
活性氧诱导氧化应激和氧化损伤
与ROS相关的疾病起源于身体的许多器官和组织,包括大脑、神经、眼睛、鼻子、牙齿、呼吸系统、循环系统、消化系统、泌尿系统、血液系统和内分泌系统、皮肤和支持组织[14]。因此,ROS已被认为与大多数疾病的发展有关。 当研究超氧阴离子(氧化应激的一个原因)的产生与寿命之间的关系时,观察到了负相关,产生更多ROS的生物体寿命更短[15]。此外,当检查SOD与生物体寿命(在总生命周期能量方面)之间的关系时,也观察到了相关性,即具有更高SOD活性水平的生物体寿命更长[16]。 ROS对生物体不仅有有害的方面,也有有益的方面。已经表明,超氧阴离子和过氧化氢在高浓度下会发挥细胞毒性作用,但在低浓度下作为信号转导分子发挥作用,并在细胞凋亡、细胞增殖和细胞分化中扮演重要角色[2, 3]。此外,高浓度的过氧化氢被抗氧化酶转化为次氯酸,并在身体对抗细菌攻击中发挥作用[2, 3]。一氧化氮对信号转导和血管舒张很重要,并被用作医用气体。另外,已经观察到氧化性优应激和劣应激之间的差异。大量的ROS会导致氧化损伤,而少量的ROS通过激活Nrf-2诱导血红素加氧酶,这是一种抗氧化酶,在体内发挥保护作用[17]。少量的ROS还会诱导p53,一种肿瘤抑制基因[18]。
线粒体功能障碍和疾病
线粒体在有氧条件下通过氧化磷酸化产生超过90%的细胞内能量,并生成ATP。这些细胞器由内外膜的双层结构组成,内外膜之间有一个膜间隙,内膜内部还有一个基质[19]。内膜的内侧有一个狭窄的嵴[19]。线粒体呼吸链复合体的五个蛋白,复合物I-V,在内膜嵴上组装,以高效产生ATP[19]。此外,许多主要由复合物I和III产生的线粒体活性氧(mtROS)被线粒体内的抗氧化系统清除,该系统包括SOD2/MnSOD、过氧化氢酶、谷胱甘肽过氧化物酶和还原型谷胱甘肽。因此,线粒体内膜呼吸链复合体的电子传递系统以及ATP合酶的氧化磷酸化维持了高效的能量产生[20, 21]。
然而,线粒体功能的异常导致ATP产生减少和mtROS增加,这反过来又因损伤线粒体内部释放的细胞色素c等凋亡信号,促进了病理条件的发展[20]。在常见的代谢性和神经退行性疾病中检测到了无线粒体遗传异常的功能失调。线粒体功能障碍还与糖尿病、动脉粥样硬化、高血压、帕金森病、急性肾损伤和肌萎缩侧索硬化症(ALS)的发病机制有关[20, 22]。
线粒体疾病是由参与线粒体功能和结构维护的各种基因异常引起的,例如ATP合成、氨基酸、脂质和蛋白质的运输,以及线粒体内氧化应激的清除[20, 23]。在线粒体疾病中,由于线粒体呼吸功能受损,主要在需要大量能量的组织如肌肉和神经中发展出临床症状,并且由于对糖酵解系统能量的依赖增加,也会诱导乳酸酸中毒[24]。
氧化应激引起的线粒体结构和功能的损害与各种疾病的发展有关;然而,H2引起的轻度应激实际上可能增强对氧化应激恶化的抵抗力。Murakami等人使用培养细胞研究了低浓度H2对线粒体的影响[25]。他们的发现揭示了H2增加了线粒体膜电位(MMP)和细胞内ATP水平[25]。用H2预处理抑制了过氧化氢诱导的细胞死亡,而治疗后则没有。此外,H2处理的细胞显示了参与Nrf-2途径的抗氧化酶的上调表达。这些发现表明,H2不仅作为自由基清除剂,而且还作为mitohormetic效应器发挥作用[25]。
氢气对线粒体功能的作用
各种疾病动物模型研究
H2 在实验动物或培养细胞的各种疾病模型中显示出功效,通过改善线粒体的结构和/或功能。因此,本章提供了文献综述,展示了H2在中风、蛛网膜下腔出血(SAH)、肌萎缩侧索硬化症(ALS)、阿尔茨海默病、心肌损伤、高血压、败血症、糖尿病神经病变和肝损伤等疾病模型中的疗效及其潜在机制(表3.1)。

脑梗塞 (Cerebral Infarction)
Cui等人研究了富氢盐水(HRS)在大鼠脑缺血/再灌注(I/R)模型中的效果,并证明了它显著增加了存活神经元的数量[26]。他们还展示了HRS不仅抑制了组织损伤、线粒体肿胀程度和线粒体膜电位(MMP)的降低,还保持了线粒体细胞色素c的含量[26]。这些发现表明,HRS通过保护线粒体功能减轻了大鼠神经元I/R损伤。
蛛网膜下腔出血 (SAH)
Zhang等人研究了氢气对SAH大鼠模型中神经元焦亡的保护效果,并报告说吸入氢气显著改善了脑水肿,提高了神经功能,并抑制了神经元焦亡[27]。此外,氢气抑制了ROS的产生、白细胞介素(IL)-1β和IL-18的表达,以及p38丝裂原活化蛋白激酶(p38 MAPK)的激活,而氢气的这些抑制效果被5-羟基癸酸(5-HD),一种线粒体ATP敏感性K+(mitoKATP)通道抑制剂所减弱[27]。总的来说,这些发现表明氢气的神经保护效果涉及mitoKATP/p38 MAPK信号通路。
肌萎缩侧索硬化症 (ALS)
Zhang等人研究了HRS在突变SOD1 G93A转基因小鼠ALS模型中的效果,并报告说它显著延迟了疾病的发作并延长了生存期[28]。他们还展示了HRS抑制了线粒体释放促凋亡因子及随后的下游caspase-3的激活[28]。此外,他们证明了HRS维持了线粒体功能,恢复了复合物I和IV的活性,减少了mtROS的产生,并促进了线粒体ATP的合成[28]。基于这些发现,他们建议氢气通过对减少氧化应激和维持线粒体功能来对抗ALS发挥神经保护效果。
阿尔茨海默病 (Alzheimer’s Disease)
Lin等人研究了富含氢气的水(HRW)对人类神经母细胞SK-N-MC细胞的细胞毒性的影响[29]。他们证明了HRW减少了过量的ROS,抑制了氧化损伤,并抑制了淀粉样β蛋白(Aβ)诱导的细胞死亡[29]。此外,他们展示了HRW刺激了AMP激活的蛋白激酶,从而上调了下游的叉头框蛋白O3a(FoxO3a)抗氧化反应,并减少了Aβ诱导的线粒体电位损失和氧化应激[29]。他们还指出了HRW作为有效治疗剂抑制Aβ诱导的神经毒性的潜力。
心肌损伤 (Myocardial Injury)
Yoshida等人研究了氢气在比格犬心肌I/R模型中的效果,并发现它减少了心肌梗死面积;然而,给予5-HD或芦荟苷,一种线粒体通透性转换孔(mPTP)开放剂,抵消了氢气对梗死面积的效果[30]。这些发现表明氢气通过打开mitoKATP通道和抑制mPTP减少了犬心脏的梗死面积。
高血压 (Hypertension)
Yu等人研究了长期给予HRW对自发性高血压大鼠(SHR)左心室肥厚的影响[31]。获得的发现显示HRW抑制了左心室炎性细胞因子的产生和核因子-κB(NF-κB)的激活[31]。此外,HRW通过恢复电子传递链酶活性、抑制ROS产生和增强ATP产生来维持线粒体功能[31]。
脓毒症相关脑病 (Sepsis-Associated Encephalopathy, SAE)
Xie等人研究了氢气对脓毒症相关脑病小鼠线粒体功能和生物合成以及相关调控机制的影响[32]。他们的发现表明,氢气延长了SAE小鼠的存活时间并保持了认知功能,增加了线粒体膜电位(MMP)和ATP水平,这些是线粒体功能的参数,以及复合物I活性的表达[32]。他们还证明了氢气上调了线粒体生物合成参数过氧化物酶体增殖激活受体γ共激活因子1α(PGC-1α)和线粒体转录因子A的表达[32]。这些发现表明,氢气通过激活PGC-1α促进线粒体生物合成,从而缓解了脓毒症引起的脑损伤。
糖尿病周围神经病变 (Diabetic Peripheral Neuropathy, DPN)
Jiao等人研究了HRS在链脲佐菌素诱导的糖尿病大鼠模型中对DPN的疗效[33]。HRS显著抑制了大鼠DPN的行为、生化和分子效应[33]。此外,5-HD部分减弱了HRS的治疗效果[33]。这些发现表明,HRS对DPN的疗效机制涉及通过激活mitoKATP途径抑制氧化应激、炎症和凋亡。
肝损伤 (Liver Injury)
Liu等人研究了HRS在梗阻性黄疸小鼠模型中的效果,发现它显著减少了线粒体肿胀、细胞色素c释放和氧化损伤[34]。他们还报告说,HRS抑制了细胞B细胞/慢性淋巴细胞白血病2(Bcl-2)相关x蛋白(Bax)的表达、caspase活性和肝细胞凋亡,并缓解了线粒体形态缺陷[34]。这些发现表明,HRS抑制了线粒体氧化应激和功能障碍,并抑制了线粒体介导的凋亡。
慢性炎症 (Chronic Inflammation)
炎症是由先天免疫系统释放的炎症细胞因子引发的。导致炎症细胞因子释放的级联反应非常复杂;然而,病原体如病毒和细菌、身体受损时产生的物质以及环境中的刺激物在引发炎症时起到信号作用[35]。这些细胞外信号导致线粒体功能障碍并诱导过量的ROS产生[36]。过量的mtROS产生和氧化的线粒体DNA(mtDNA)的释放触发了核苷酸结合和寡聚化结构域样受体家族含pyrin结构域3(NLRP3)炎症小体的形成,这是一个蛋白质复合体[37, 38]。然后NLRP3炎症小体激活蛋白酶caspase 1,从免疫细胞如巨噬细胞和中性粒细胞中释放成熟的转化炎症细胞因子,导致炎症[37, 38](图3.2)。
我们对H2抑制急性和慢性炎症的文献进行了综述[38]。许多研究报告称,H2对mtROS产生的抑制与H2的抗炎效果有关[38]。然而,这些研究并未具体说明所涉及的ROS[39,40,41]。在ROS中,·OH具有很强的氧化性,不仅会导致核DNA损伤,还会导致mtDNA损伤并诱导细胞死亡。H2是一种对线粒体具有极佳渗透性和选择性清除·OH能力的物质[4]。因此,我们展示了H2改善慢性炎症的机制可能涉及H2减少·OH,保护mtDNA免受氧化损伤,从而抑制了从激活NLRP3炎症小体到释放炎症细胞因子的一系列信号事件[38]。在这篇综述中,我们提出了H2抑制·OH产生可能是抑制随后炎症信号的机制[38](图3.2)。
然而,其他研究人员指出,除ROS之外的细胞反应下游信号通路也参与了H2介导的抑制炎症的机制。
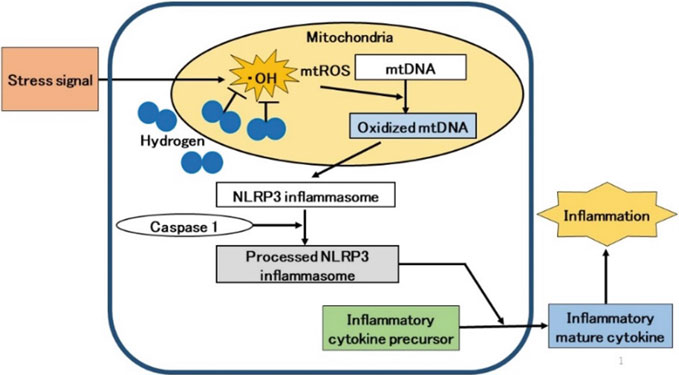
图. 3.2 线粒体参与炎症细胞因子的释放。氢气通过抑制mtROS的产生,从而抑制了从NLRP3炎症小体激活到炎症细胞因子释放的级联反应。
氢气对新冠后遗症和慢性疲劳的作用
Guan等人在一项开放标签研究中评估了氢气和氧气混合吸入疗法对COVID-19患者的疗效[46]。他们证明了氢气和氧气混合疗法在改善COVID-19的严重程度、呼吸困难、咳嗽、胸闷、胸痛和氧饱和度方面优于对照治疗[46]。尽管吸入氢气可以改善COVID-19的肺炎症状,但问题不仅仅在于这种感染,还在于感染后的“后遗症”[47, 48]。换句话说,COVID-19是由SARS-CoV-2引起的病毒感染,影响呼吸系统、消化系统和血管系统。急性症状通常在两到三周内解决。然而,对于某些患者,恢复期延长,“后遗症”可能在最初感染后持续数月[47, 48]。这些“后遗症”据报道包括疲劳、呼吸困难、肌肉疼痛、运动不耐受、睡眠障碍、注意力不集中、焦虑、发热、头痛、不适以及许多其他慢性症状[47, 48]。COVID-19的“后遗症”被称为post-COVID-19或long-COVID-19。
Terkek等人最近报告了一项随机、单盲研究的结果,研究了氢气吸入对急性post-COVID-19患者身体和呼吸功能的影响[49]。他们展示了氢气吸入比安慰剂气体更有效地减轻急性post-COVID-19患者的临床症状,因为氢气显著改善了步态测试中的身体功能和肺功能测试中的呼吸功能[49]。这些发现表明,氢气吸入不仅对COVID-19患者的肺炎症状有治疗作用,还对post-COVID-19患者的身体和呼吸功能有治疗作用。
Post-COVID-19可能与ME/CFS相同,其特征是持续超过6个月的严重疲劳、劳累后的极度疲惫、记忆损害、注意力问题和睡眠障碍作为主要症状[50]。尽管ME/CFS的病因尚不清楚,但线粒体功能障碍已被报道为其原因之一[51,52,53,54]。由于ME/CFS和post-COVID-19的症状非常相似,人们争论但尚未证实这两种疾病可能由相同的机制引起[55]。
为了开发ME/CFS的治疗方法和疗法已经做出了巨大的努力;然而,已经开发的治疗和疗法是对症的,而不是治愈性的治疗[56]。我们进行了文献综述并展示了氢气改善了实验动物和健康个体由急性或慢性运动压力引起的疲劳,这种疲劳是由ROS引起的线粒体功能障碍所致,氢气不仅通过减少·OH改善了急性和慢性疲劳,还通过减少·OH改善了ME/CFS的发病机制(Fig. 3.3)[57]。我们还对四名ME/CFS患者进行了氢气吸入的案例研究,发现它减轻了如“脑雾”、疲劳、从劳累中恢复的时间、头痛、注意力不集中和睡眠障碍等症状[58]。尽管氢气在许多患者中的疗效需要在未来的随机对照试验中得到确认,但吸入氢气不仅对post-COVID-19有效,也对ME/CFS有效。
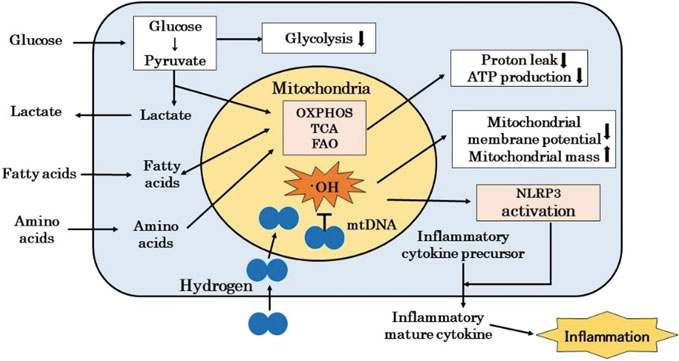
图3.3 氢气改善ME/CFS患者线粒体功能障碍的可能机制。患者的线粒体显示出降低的糖酵解能力和异常的代谢。这些线粒体表现出减少的质子泄漏、ATP产生和线粒体膜电位,以及增加的线粒体质。氢气通过清除·OH来改善线粒体功能障碍,并阻断了从NLRP3激活到炎症细胞因子释放的级联反应。OXPHOS:氧化磷酸化,TCA:三羧酸循环,FAO:脂肪酸氧化。
未来医学的前景
我们在此概述了先前研究的发现,这些研究表明氢气通过保护/改善各种动物和细胞模型中线粒体的结构和/或功能来改善疾病。透射电子显微镜显示,氢气对线粒体形态具有保护作用[26, 34]。生化和分子评估氢气对线粒体功能的保护作用表明,它抑制了ROS的产生和IL-1β及IL-18的表达,并增强了ATP的产生、MMP以及复合物I活性。关于氢气的药理学评估,给予5-HD(mitoKATP通道的抑制剂)和atractyloside(mPTP的开放剂)减弱了氢气的效果,这表明氢气通过开放mitoKATP通道和抑制mPTP来保护线粒体功能[27, 30, 33]。此外,氢气抑制了caspase-3和-9的活性,抑制了细胞色素c的释放和Bax的表达,并增加了Bcl-2的表达,表明它通过抑制细胞凋亡来保护线粒体功能[34]。总的来说,这些实验发现表明氢气通过调节线粒体中ROS的产生来保护线粒体的形态和/或功能。
由线粒体功能障碍或衰竭产生的ROS会导致起源于身体各种器官和组织的各种疾病[14]。另一方面,涉及慢性炎症的疾病也源于身体的各种器官和组织[14]。因此,虽然ROS是许多疾病的原因,但慢性炎症也在它们的病理发生中起着作用。我们检查了氢气改善慢性炎症的机制,并发现它们可能涉及基于氢气减少·OH的对线粒体的保护作用[38]。我们还假设氢气改善post-COVID-19和ME/CFS的机制可能涉及基于氢气减少·OH的对线粒体的保护作用[57]。
现代医学的特点是将人体视为器官的集合,并将研究对象从器官细分到细胞,再到分子,最后到基因,以确定对疾病影响最大的因素。然而,许多疾病不是由单一因素引起的,而是由多种因素和广泛的机制引起的。氢气是一种超出现代医学范围的物质,因为它通过对ROS和慢性炎症的作用,这些是疾病的根本原因,对多种疾病都有广泛的影响[38]。
氢气医学的一个限制是,因为氢气用于治疗多种疾病,患者独立购买和使用氢气水或氢气吸入器,没有医疗监督,可能会恶化病情。尽管已进行了多项临床研究,但对个别疾病的剂量和用药量的研究还处于初期阶段。需要对个别疾病进行更多的基础和临床研究。此外,Jin等人最近确定了氢气的一个靶分子[59]。氧化形式的卟啉催化氢气与OH的反应,减少氧化应激[59]。然而,关于氢气靶分子的研究仍处于早期阶段,因此需要进一步研究。
结论
我们在此报告了氢气对各种实验性细胞和动物模型以及包括ME/CFS和post-COVID-19在内的几种人类慢性炎症性疾病的影响。我们展示了它通过保护线粒体功能来发挥作用,这是由于其对mtROS的调节。此外,我们已经表明,由线粒体功能障碍引起的氧化应激和慢性炎症可能导致各种疾病。由于未来的医学将需要开发保护和激活线粒体功能的技术和方法,氢气可能因其对线粒体功能的影响而成为未来医学的候选物质。
https://m.sciencenet.cn/blog-41174-1423170.html
上一篇:解开生命起源的谜题
下一篇:有些遗传病不仅仅是遗传病