博文
代谢学人——Nature Metabolism:脂肪围攻,血管相助
||
代谢学人
Nature Metabolism:脂肪围攻,血管相助
撰文 | 张彦康 郑宇含 王佳雯 李雨
编辑 | 孟美瑶
校对 | 张婷

背景介绍
肥胖过程伴随着脂肪组织中脂肪细胞的增生和肥大,因此在肥胖发生后,脂肪组织需要通过血管生成维持庞大的血管网络提供丰富的氧气和营养物质。脂肪组织扩张通常伴随着血管生成,脂肪细胞通过分泌内皮细胞特异性丝裂原和促血管生长因子,促进血管生成。但当血管生成的速度与脂肪组织扩张的速度不匹配,新生血管的数量无法满足过度扩张的脂肪组织时,脂肪组织便会局部缺氧,并加重炎症反应。研究表明,缺氧诱导因子(HIF)是重要的氧感知及应答的关键效应因子,在肥胖的早期阶段,缺氧环境使脂肪组织内Hif-1α表达增加,进一步促进脂肪组织纤维化和炎症反应,加重高脂饮食诱导的肥胖和胰岛素抵抗。因此,血管生成障碍与脂肪组织功能紊乱存在紧密联系。
ECs(Endothelial cells,内皮细胞)作为血管和组织之间的屏障,排列在血管内壁,是组织的营养“守门人”。ECs在血管生成过程中起重要作用,成年人的ECs大多数处于静息状态,通常在血管内皮生长因子(如VEGF)刺激下转换为激活状态,通过增殖、分支、连接以及重塑形成功能性血管回路,介导血管生成,为代谢组织(如脂肪和肌肉)提供了氧气和营养物质。例如,LPL(脂蛋白脂酶)是一种胞外酶,可通过硫酸肝素蛋白聚糖锚定在血管内皮细胞表面,水解血液中的甘油三酯释放FFA,FFA则通过脂肪细胞质膜上的脂肪酸转运体如FATP被脂肪细胞吸收。
近年来研究发现,ECs作为器官组织中和血液直接接触的细胞,在感知及调控机体代谢变化中起重要作用。尽管已有研究报道靶向ECs可以调控小鼠肥胖及全身代谢,如ECs特异性敲除AGO1小鼠可以通过促进白色脂肪棕色化抵抗高脂饮食诱导的肥胖并改善代谢紊乱。但是ECs与其他细胞如脂肪细胞的具体交流机制目前仍不清楚。
PTEN(同源性磷酸酶)是一种脂质磷酸酶,可负调控PI3K介导的信号通路。PI3K(磷脂酰肌醇-3-激酶)可通过磷酸化PIP2(磷脂酰肌醇(4, 5)二磷酸)产生PIP3(磷脂酰肌醇(3, 4, 5)三磷酸),作为第二信使启动下游通路如PDK1、AKT、mTORC1等,促进细胞生长、增殖、迁移及运输等功能。而PTEN则可以去磷酸化PIP3形成PIP2,抑制该通路,因此抑制Pten活性可通过激活PI3K途径促进细胞增殖。ECs的增殖对PI3K信号非常敏感,过多或过少的PI3K信号都会导致血管生成异常。研究发现,PI3K信号通路可通过抑制肌球蛋白的收缩性,从而促进血管生成以及ECs增殖,而抑制PI3K活性会促进肌球蛋白的收缩性,并损害ECs增殖过程中连接的重塑和稳定性,使ECs不能正确地排列,在血管内皮形成异常的叠加层,导致血管生成异常。
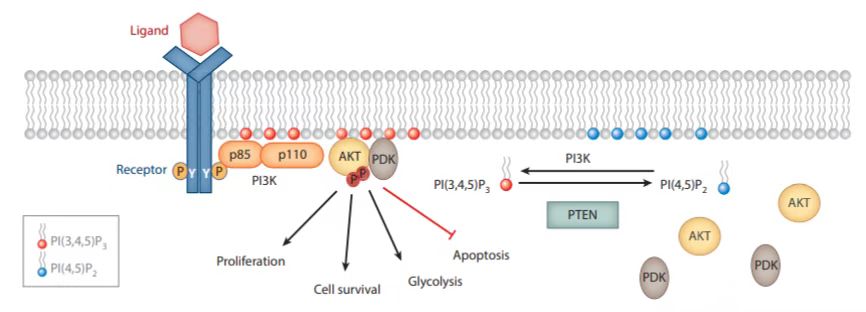
在本篇文章中,研究人员通过内皮特异性敲除Pten基因构建ECs增殖模型,研究ECs与脂肪组织的相互作用机制,揭示了内皮细胞通过分泌多胺与脂肪细胞相互交流,以促进脂肪组织血管生成,从而缓解肥胖。
敲黑板啦!
1.内皮Pten缺失可抵抗肥胖
2.内皮Pten缺失可提高WAT代谢率
3.Pten缺失的EC增殖依赖于脂肪酸代谢
4.多胺是血管分泌的促脂解的代谢介质
5.多胺激活β-ADR促进脂解
6.抑制AMD1可抑制Pteni∆EC小鼠的减肥现象
1
1、内皮Pten缺失使小鼠变瘦
内皮细胞被认为是组织的营养“看门人”,为了了解其在组织代谢中的作用,研究人员构建了促进EC(内皮细胞)增殖的小鼠模型。由于EC增殖主要由PI3K信号调控,而Pten(同源性磷酸酶)通过去磷酸化PI3K来抑制PI3K信号通路,因此研究人员将Ptenflox/flox小鼠与Pdgfbi-CreERT小鼠杂交构建PteniΔEC小鼠(内皮组织特异性敲除Pten小鼠),PteniΔEC小鼠出生后(第2天和第3天)在4-OHT(4-羟基三苯氧胺)的诱导下实现内皮组织的Pten基因敲除。为了证明Pten在内皮组织中被特异性敲除,研究人员采用了Ribotag小鼠模型,该小鼠模型的Rpl22(核糖体蛋白)基因序列上插入了loxp位点和HA位点,当Ribotag小鼠与组织特异性Cre小鼠杂交后,Cre重组酶会诱导HA-Rpl22蛋白在特定组织中表达,Rpl22蛋白会整合到核糖体中促进蛋白质翻译。研究人员将Ribotag小鼠与Pdgfbi-CreERT小鼠杂交构建RibotagiHAEC小鼠,发现RibotagiHAEC小鼠组织中只有内皮组织特异性基因表达水平升高(Extended Data Fig.1a,b),且PteniΔEC-RibotagiHAEC和PteniΔEC小鼠组织中只有内皮组织Pten基因缺失(Extended Data Fig.1c-g)。
接下来,研究人员监测PteniΔEC小鼠表型,发现内皮组织特异性敲除Pten基因后,小鼠体重显著下降,WAT(包括iWAT和eWAT)重量和脂肪细胞大小明显减少,且体脂显著下降,而其他组织(BAT、心脏、胰腺、肾、肝)重量并没有明显变化(Fig.1a-h and Extended Data Fig.2a-c)。此外,并没有发现肝脏和肌肉中的脂质异位沉积、WAT纤维化以及脂肪细胞分化异常和细胞死亡现象(Fig.1i-j and Extended Data Fig.2d-j)。且随着脂肪组织含量的减少,血液中瘦素水平也随之降低(Extended Data Fig.2k)。
随后研究人员进一步研究了内皮组织Pten缺失对血管系统的影响,发现敲除内皮Pten基因5周后,WAT中血管含量显著增加,EC增殖明显提高(Fig.2a-h,Extended Data Fig.3c),而小鼠体重并没有差异(Fig.1d,g),说明血管增殖现象的发生先于体重下降。在WAT组织中VEGF(血管内皮生长因子)信号通路并没有发生变化(Extended Data Fig.3d),说明VEGF信号通路没有在血管增殖中发挥主要作用。此外, WAT中也没有出现血管受损现象(Extended Data Fig.3e)。由于BAT与WAT的功能类似,因此研究人员对BAT进行了分析,发现PteniΔEC小鼠BAT中血管含量略有增加,且BAT组织形态并没有明显变化;此外其他组织中(脑、肌肉、肝、心脏)血管含量没有差异(Extended Data Fig.3a-b,3f)。
为了研究特异性敲除内皮Pten对血管密度和肥胖的影响,研究人员采用了两种研究方法。首先,研究人员对成年PteniΔEC小鼠(8周龄)进行三苯氧胺诱导以敲除内皮Pten基因,排除了Pten基因缺失对小鼠发育的影响,发现PteniΔEC小鼠再现了WAT血管生成增加以及WAT组织重量减轻现象(Extended Data Fig.4a-h)。随后,研究人员利用由VE-cadherin(小编注:Pdgfb和VE-cadherin(即Cdh5)都在内皮细胞中特异性高表达。Pdgfb属于血小板源性生长因子家族,主要是通过pdgfb受体发挥作用,在血管形成过程中招募周细胞促进血管生成。Cdh5则一般通过介导细胞间的黏附连接,促进胚胎发育早期阶段的血管发生和重塑。这两种小鼠模型分别在06年和08年被报道(Arnaud Monvoisin et al, 2006; Suzanne Claxton et al, 2008)),并证明了在内皮细胞中的特异性。目前这两种模型均被用于对内皮细胞功能的研究。)启动子调控的靶向内皮组织的诱导Cre递送系统,即Cdh5-CreERT2小鼠模型,在PteniΔEC小鼠出生后(第2天和第3天),通过4-OHT诱导内皮Pten基因敲除,也发现PteniΔEC小鼠WAT出现血管生成增加与WAT重量减轻现象,而其他组织没有显著变化(Extended Data Fig.4i-p)。总之,这些结果表明内皮Pten特异性缺失可促进WAT中血管生成,并减少WAT中的脂质堆积。
Fig.1 PteniΔEC小鼠可缓解肥胖
Fig.2 PteniΔEC小鼠WAT中血管数量和EC增殖增加
Extended Data Fig.1 验证PteniΔEC中的Pten缺失
Extended Data Fig.2 内皮Pten缺失导致脂肪量减少,与纤维化、分化改变或细胞死亡无关
Extended Data Fig.3 PteniΔEC小鼠组织的血管分子和组织学特征
Extended Data Fig.4 内皮Pten缺失的体内表征
2
2、内皮Pten缺失可抵抗肥胖
脂肪组织过度积累不仅会引起肥胖,也会抑制WAT中血管生成。因此研究人员在肥胖小鼠和人的样本上探究血管生成抑制是否与PTEN表达水平相关,发现与正常饮食相比,在HFD喂养小鼠WAT中血管含量下降,且Pten基因表达水平升高(Extended Data Fig.5a-c)。并且在肥胖人体的VAT(内脏脂肪组织)中也发现血管生成抑制以及Pten基因表达水平上调(Extended Data Fig.5d-f and Supplementary Table 4)。因此,这些结果表明在肥胖条件下Pten表达水平与血管生成呈负相关关系。
据报道,促进WAT血管生成可改善肥胖相关代谢并发症,因此研究人员探究了PteniΔEC小鼠是否可以抵抗肥胖发生。首先,研究人员对PteniΔEC小鼠和WT小鼠进行HFD饮食喂养,发现PteniΔEC小鼠体重、WAT重量和脂肪细胞大小均显著低于WT小鼠,而其他组织(BAT、心脏、胰腺、肾、肝)重量与WT小鼠相比没有发生差异性变化。此外,在HFD喂养下,PteniΔEC小鼠WAT中血管含量显著高于WT小鼠,WAT纤维化现象没有差异,糖稳态也明显改善(Fig.3a-g; Extended Data Fig.6a-f)。随后,为了验证在已经肥胖的小鼠中敲除内皮Pten是否可以改善肥胖,研究人员对喂养HFD饮食12周的小鼠给药三苯氧胺诱导,敲除内皮Pten基因,发现PteniΔEC小鼠体重显著下降,WAT血管含量显著增加,且不影响WAT纤维化,小鼠糖稳态显著改善(Fig.3h-n; Extended Data Fig.6g-k)。这些结果表明敲除内皮Pten不仅可以在生理条件下预防肥胖发生,也可以在肥胖的病理条件下改善肥胖。
Fig.3 PteniΔEC小鼠抵抗饮食诱导的肥胖
Extended Data Fig.5 在小鼠和人类白色脂肪组织中,内皮Pten表达下调与血管含量增多相关
Extended Data Fig.6 内皮Pten表达下调与葡萄糖代谢改善相关
3
3、内皮Pten缺失可提高WAT代谢率
接下来研究人员进一步研究了内皮Pten缺失诱导小鼠体重降低的机制。首先研究人员监测了与能量摄入和能量消耗相关的因素,发现PteniΔEC小鼠体重降低与摄食量、肠道吸收、活动量、BAT产热以及WAT棕色化这些因素无关(Fig.4a-h) (小编注:也有研究证明促进血管生成可促进皮下脂肪和棕色脂肪的棕色化与产热。参考文献:Xiaofang Tang et al, 2020)。但PteniΔEC小鼠能量消耗增加,血液中TG水平下降(Fig.4i-j)。为了研究PteniΔEC小鼠能量消耗增加与体重减轻之间的联系,研究人员检测各组织的线粒体功能,发现PteniΔEC小鼠中只有WAT线粒体呼吸能力增强,而其他组织(肌肉、肝)的线粒体呼吸没有发生变化(Fig.4k–n)。因此,这些结果表明内皮Pten缺失促进血管生成和EC增殖,可进一步通过促进WAT线粒体呼吸,增强全身能量消耗,引起体重下降。
Fig.4 内皮细胞Pten缺失与WAT脂质动员增强相关
4
4、Pten缺失的EC增殖依赖于脂肪酸代谢
研究人员推测,PteniΔEC小鼠能量消耗的增加以及WAT中线粒体活性的增强可能部分由WAT中ECs增殖导致的血管生成增加介导的。鉴于WAT是储存脂质的组织,WAT中ECs对脂质的利用较为方便,且ECs细胞增殖和血管生成需要脂肪酸的氧化来提供必需的能量和底物dNTP(小编注:脂肪酸氧化生成乙酰辅酶A进入TCA循环生成二氧化碳和ATP,为dNTP的合成提供碳源),因此研究人员探究了WAT中特异性的血管生成增加是否由于PteniΔEC小鼠WAT中ECs的脂代谢相关转录程序改变。研究人员检测了PteniΔEC小鼠体内WAT中内皮组织和体外原代脂肪ECs(小编注:原代ECs分离:通过中性蛋白酶37℃消化脂肪1h,然后用涂有抗小鼠血管内皮钙粘蛋白抗体的磁珠阳性选择,将细胞接种板/皿中,并在含有0.5%明胶,20%的胎牛血清和内皮细胞生长因子的DMEM/F12中培养)的脂质分解代谢相关基因表达水平,发现敲除内皮Pten基因后,内皮细胞中脂肪酸转运体相关基因、脂肪酸β氧化(FAO)相关基因以及能量代谢途径相关基因表达显著上调(Fig.5a-b),且FAO途径增强(Fig.5c)。与之前结果一致,这些变化只在WAT内皮细胞中特异性发生,在其他组织(BAT、肌肉、肝)的内皮细胞中并无差异(Extended Data Fig.7a-c)。研究人员在培养原代脂肪ECs的培养基中添加脂质,发现内皮细胞的线粒体呼吸增加(Fig.5d, e),对体外培养来源于肺组织的ECs的培养基中添加脂质,发现敲除Pten基因后ECs的脂质分解代谢相关基因表达上调,FAO途径以及线粒体呼吸增强现象(Extended Data Fig.7e-i);而在富含葡萄糖的原代脂肪ECs培养基培养条件下,内皮细胞的线粒体呼吸以及葡萄糖摄取没有明显变化(Fig.5f, g)。因此,研究人员推测可能是脂肪ECs对脂肪酸的利用率增加促进了WAT的血管生成。为了进一步证明这一点,研究人员分别利用etomoxir(一种FAO药物抑制剂)处理eWAT组织和原代脂肪ECs,发现etomoxir抑制了Pten敲除引起的EC增殖现象,而其他组织没有差异(Fig.5h-j; Extended Data Fig.7j)。随后研究人员又采用遗传手段进一步验证WAT血管生成是否依赖于脂肪ECs对脂肪酸的利用,基于前文基因表达数据显示,与脂质转运、脂肪酸β氧化和氧化磷酸化相关基因显著增加,而这些基因受PGC1家族因子的转录调控,同时还发现Ppargc1b(编码PGC1β)的转录上调(Fig.5a, b),因此研究人员构建了Pgc1βiΔEC小鼠(调控脂质代谢的Pgc1β内皮特异性敲除的小鼠),并与PteniΔEC小鼠杂交产生PteniΔEC-Pgc1βiΔEC小鼠,发现在内皮Pten缺失后可促进WAT血管增殖,而在此基础上敲除内皮Pgc1β基因,可抑制WAT血管生成(Extended Data Fig.7k,l)。总之,这些结果说明,在脂质丰富的微环境中,Pten敲除使ECs脂肪酸代谢增强,从而促进增殖。
Fig.5 脂质氧化对Pten缺失的内皮细胞增殖至关重要
5、多胺是血管分泌的促脂解的代谢介质
上文结果表明FAO对于维持脂肪ECs增殖至关重要,但用药理或遗传手段抑制FAO后eWAT重量依然显著下降(Fig.5k and Extended Data Fig.7m),说明PteniΔEC小鼠体重下降不仅仅是由促进EC增殖而引起的。研究人员推测可能是在内皮Pten缺失时血管通过分泌信号分子来调控脂肪组织的脂解作用,这也可以解释抑制FAO后体重仍可以降低的现象。于是研究人员体外培养PteniΔEC小鼠的eWAT外植体或原代脂肪细胞,并检测培养基中FFA(游离脂肪酸)水平,发现与对照相比,敲除内皮Pten后WAT的FFA释放量明显升高(Extended Data Fig.8a and Fig.6a-b)。同时,在禁食条件下,与对照相比,PteniΔEC小鼠血液中FFA水平也显著升高(Fig.6c)。表明内皮Pten缺失可促进脂肪组织脂解。据报道,β-ADRs(β-肾上腺素能受体)的激活可促进WAT脂解,因此研究人员探究了β-ADRs是否介导PteniΔEC小鼠WAT的脂解过程。研究人员用propranolol(pan-β-ADR抑制剂)处理PteniΔEC小鼠4天,检测eWAT脂解水平,发现propranolol处理显著抑制了eWAT外植体的脂解能力,表明β-ADR的激活可促进内皮Pten缺失诱导的WAT脂解水平(Fig.6d)。因此,基于这些结果表明在内皮Pten缺失时血管分泌的信号分子可能通过激活β-ADR促进WAT脂解。
据报道,血管分泌的信号分子作为联系EC功能与组织稳态的关键介质,调控着多种生理或病理过程,这些信号分子通常为多肽、代谢物或细胞外囊泡。因此,为了鉴别PteniΔEC小鼠血管分泌的信号分子特性,研究人员经过滤培养PteniΔEC小鼠原代脂肪ECs的培养基,将培养基中的代谢物与蛋白和囊泡分离(Extended Data Fig.8b),发现只有富含代谢物成分的培养基可以促进PteniΔEC小鼠eWAT外植体脂解,而含蛋白质成分或囊泡成分的培养基无法促进其脂解(Fig.6e,f)。说明PteniΔEC小鼠WAT中促进脂解的血管分泌信号分子是一类代谢物。
接下来,研究人员进一步推断血管分泌信号分子的代谢性质,并设定了3个推断标准:1. 已被证明和肥胖相关;2. 以旁分泌方式发挥生物学功能;3. 可感应PI3K信号。研究人员发现多胺满足了这3个标准,研究证明多胺可以以旁分泌方式发挥作用,并促进肥胖小鼠降低体重,且PI3K的激活可促进多胺的合成从而发挥致癌作用。因此研究人员推测多胺可能是PteniΔEC小鼠WAT中血管分泌的促脂解信号分子。多胺是由甲硫氨酸和鸟氨酸合成的聚阳离子代谢物,因此研究人员用13C标记的甲硫氨酸示踪发现,在PteniΔEC小鼠脂肪ECs中与多胺合成相关的代谢物含量增加,包括13C标记的亚精胺和精胺(Fig.6g and Extended Data Fig.8c)。并且,代谢组学分析结果也表明PteniΔEC小鼠脂肪ECs和WAT组织中多胺水平显著升高(Fig.6h, i and Extended Data Fig.9a, b)。此外,在PteniΔEC小鼠脂肪ECs培养基中也发现多胺水平升高,证明了多胺的可分泌性(Fig.6j)。
拓展阅读
培养基中的不同组分分离
一般通过超滤法来分离培养基中的不同组分,通常选用的滤膜为3kDa。由于培养基中大于3kDa的成分主要是蛋白和囊泡,代谢物则属于小分子物质,通常小于1kDa。因此在超滤后,代谢物成分主要位于滤过的培养基中,而蛋白和囊泡则被滤膜截留,重新用培养基洗涤后可以得到含有蛋白和囊泡的培养基。本文中,研究人员利用3kD的滤膜将培养过PteniΔEC小鼠脂肪组织中原代内皮细胞的培养基分为了富含代谢物和富含蛋白与囊泡的两部分,通过处理小鼠eWAT外植体,证明了内皮细胞可能主要通过释放代谢物促进WAT脂解。
Fig.6 内皮衍生的多胺刺激脂解
Extended Data Fig.8 内皮Pten缺失导致多胺水平升高
Extended Data Fig.9 内皮Pten缺失导致无标记多胺水平增加
6、多胺激活β-ADR促进脂解。
接下来,为了进一步研究多胺调控WAT脂解的作用机制,研究人员在WT小鼠原代脂肪EC培养基中添加13C标记的亚精胺,发现亚精胺可以被原代脂肪细胞有效吸收(Fig.7a)。由于PteniΔEC小鼠WAT脂解增加依赖于β-ADR的激活(Fig.6d),而有研究表明多胺可以促进β-ADR活性。因此为了验证多胺是否依赖于β-ADR促进WAT脂解,研究人员在WT小鼠eWAT外植体和原代脂肪细胞的培养基中添加亚精胺,发现eWAT外植体和原代脂肪细胞的脂解水平增加,而加入propranolol抑制β-ADR后脂解被抑制(Fig.7b-c and Extended Data Fig.10a-b)。研究表明β-ADR通过激活cAMP-PKA来传递促脂解信号,因此研究人员检测了原代脂肪细胞中cAMP含量,发现补充亚精胺显著促进了原代脂肪细胞中cAMP的产生(Fig.7d and Extended Data Fig.10c)。总之,这些结果表明多胺是血管分泌的促脂解信号分子,通过激活β-ADR促进脂肪组织脂解。
为了证明血管分泌的多胺是抵抗肥胖的关键调节因子,研究人员在小鼠模型上评估了多胺对缓解肥胖的效果。给WT小鼠饲喂6周的HFD或添加亚精胺的HFD饮食,发现补充亚精胺后,可显著缓解小鼠肥胖现象,并特异性降低WAT重量,减少脂肪细胞大小,并改善小鼠糖稳态(Fig.7e-j and Extended Data Fig.10e-g),此外小鼠的摄食量也显著下降(Extended Data Fig.10h)。为了证明多胺介导的体重下降不仅仅是由于摄食量的减少,研究人员将WT小鼠的摄食量限制在同等水平,发现补充亚精胺10周后,小鼠体重显著减轻(Extended Data Fig.10i)。此外,研究人员还进一步探究了肥胖状态是否与WAT中多胺水平的降低有关,发现HFD小鼠和肥胖人群的WAT中多胺水平均显著下降(Fig.7k, l and ExtendedData Fig.10 j)。总之,这些结果表明血管分泌的多胺通过激活β-ADR促进WAT脂解,从而缓解肥胖,而WAT中多胺水平的下降与机体的肥胖呈负相关关系。
Fig.7 多胺调控β-ADR依赖性脂解作用
Extended Data Fig.10 HFD小鼠补充亚精胺改善葡萄糖代谢
7、抑制AMD1可抑制PteniΔEC小鼠的减肥现象
先前研究中,研究人员已在前列腺癌中证明了PI3K信号通路和多胺生物合成之间的分子机制,即Pten缺失可激活mTORC1(mTOR复合物1),促进Amd1(S腺苷甲硫氨酸脱羧酶1)蛋白表达,提高dcSAM(脱羧基的S腺苷甲硫氨酸)水平,从而促进多胺的生物合成。PteniΔEC小鼠WAT及原代脂肪EC的dcSAM水平显著增加(Extended Data Fig.9a,b),且在Pten敲除的EC中Amd1蛋白水平显著上调(基因表达水平检测无变化),雷帕霉素(mTORC1抑制剂)可显著抑制Amd1蛋白上调(Fig.8a-b and Extended Data Fig.10k-m)。
为了进一步探究Amd1活性与PteniΔEC小鼠表型之间的联系,研究人员利用SAM486A(Amd1特异性抑制剂)处理WT和PteniΔEC小鼠的eWAT外植体,显著抑制了PteniΔEC小鼠eWAT的脂解水平,但并不影响WT小鼠eWAT脂解水平(Fig.8c-e)。此外利用SAM486A治疗PteniΔEC小鼠后,小鼠体重和eWAT重量显著升高(Fig.8f-k)。总之,这些结果说明,在内皮Pten缺失情况下,可通过促进Amd1活性促进多胺的生物合成,多胺作为血管分泌的代谢调节分子,促进WAT脂解,并缓解肥胖。
Fig.8 AMD1药理学调节肥胖
总结
总之,本篇文章发现了ECs通过释放血管分泌因子多胺调控WAT功能与机体整体代谢的分子机制。在ECs中Pten的缺失促进了小鼠的能量消耗,减轻肥胖。其具体机制是Pten缺失激活PI3K信号通路,促进WAT中EC增殖和血管生成,改善肥胖状态下的血管密度降低。此外ECs中PI3K可通过激活mTORC1-Amd1通路,促进多胺的生物合成,多胺以旁分泌的方式激活β-ADR,从而促进WAT代谢活性和脂解,缓解肥胖并改善全身代谢稳态。而WAT脂解释放的FFA又进一步促进ECs增殖和血管生成。该研究结果可能为肥胖及其相关代谢疾病的治疗提供了潜在分子靶点。
关注微信公众号代谢学人
了解更多前沿资讯

https://m.sciencenet.cn/blog-3483272-1337495.html
上一篇:代谢学人--Nature Metabolism 4月刊代谢精选
下一篇:代谢学人--Science近期代谢研究精选