博文
Cell Metabolism 8月刊代谢精选
||
撰文 | 郑宇含 张婷 王佳雯 张彦康 李雨
编辑 | 孟美瑶
校对 | 张彦康

猫猫队立大功

猫猫队闯大锅

Cell Metabolism
1、肥胖时T-bet+ B细胞在脂肪组织中积累并加剧代谢紊乱
肥胖患者代谢失衡新发现,T-bet+ B细胞成帮凶
中文摘要

拓展阅读
肥胖时eWAT中不同免疫细胞群如何变化
瘦子的eWAT中富含各类免疫细胞,如抗炎巨噬细胞,2型先天性淋巴样细胞和调节性T细胞(Treg),这些细胞可以抑制炎症,以维持组织稳态。但在肥胖状态下,这种抗炎状态就会被扰乱,导致促炎免疫细胞的积累。例如,21年发表的一项研究发现在肥胖状态下,eWAT组织中Treg细胞群会大量消失,进一步研究表明长期肥胖的小鼠eWAT中pDC(浆细胞样树突状细胞)富集,分泌大量IFN-α(促炎细胞因子),抑制Treg中 PPARγ表达,导致eWAT中Treg数量减少。而恢复eWAT中Treg数量,可增强胰岛素敏感性,改善肥胖诱导的代谢稳态。也有项研究利用单细胞测序技术解析HFD小鼠eWAT组织包含的主要细胞类型,将巨噬细胞分为4个亚群:PVM(血管周样巨噬细胞)、非血管周样巨噬细胞(NPVM)、脂相关巨噬细胞(LAM)和增殖性脂相关巨噬细胞(p-LAM),测序结果发现HFD诱导的肥胖导致LAM和p-LAM增加,而PVM和NPVM减少。
在本篇文章中,研究人员发现肥胖条件下脂肪组织T-bet+ B细胞数量显著增加,T-bet+ B细胞分泌的IgG2c可促进脂肪组织的炎症反应,从而加剧了肥胖诱导的代谢紊乱,而特异性清除B细胞中Tbx21以降低血清IgG2c水平,有效改善了肥胖小鼠的代谢稳态。
参考文献:
T-bet+ B cells accumulate in adipose tissue and exacerbate metabolic disorder during obesity
一作:ThomasHägglöf PI:Elizabeth A.Leadbetter
发表单位:Department of Microbiology, Immunology & Molecular Genetics, UT Health
Obesity is accompanied by inflammation in adipose tissue, impaired glucose tolerance, and changes in adipose leukocyte populations. These studies of adipose tissue from humans and mice revealed that increased frequencies of T-bet+ B cells in adipose tissue depend on invariant NKT cells and correlate with weight gain during obesity. Transfer of B cells enriched for T-bet+ cells exacerbates metabolic disorder in obesity, while ablation of Tbx21 specifically in B cells reduces serum IgG2c levels, inflammatory cytokines, and inflammatory macrophages in adipose tissue, ameliorating metabolic symptoms. Furthermore, transfer of serum or purified IgG from HFD mice restores metabolic disease in T-bet+ B cell-deficient mice, confirming T-bet+ B cell-derived IgG as a key mediator of inflammation during obesity. Together, these findings reveal an important pathological role for T-bet+ B cells that should inform future immunotherapy design in type 2 diabetes and other inflammatory conditions.
原文链接:https://www.sciencedirect.com/science/article/pii/S1550413122003011
修勾好像都有个特点
走着走着就容易摔跤


啪叽量过高,太可爱啦~
肝细胞癌(HCC)也有个特点
就是怕外源精氨酸缺陷
一旦缺陷就会减缓其在体外和体内的生长
近期Cell Metabolism研究发现
联合饮食中的精氨酸剥夺、
GCN2抑制和衰老疗法
能促进HCC细胞凋亡和肿瘤消退
Cell Metabolism
2、抑制GCN2可使精氨酸缺乏的肝癌细胞对抗衰老治疗敏感
多方联合显奇效,肝癌治疗新思路!
中文摘要
肝细胞癌(HCC)作为一种典型的致命性恶性肿瘤,遗传异质性高而治疗策略有限。本文中,研究人员证明了HCC细胞中尿素循环基因表达被持续抑制,从而大量摄入外源精氨酸。令人惊讶的是,HCC对精氨酸的摄入只依赖于阳离子氨基酸转运体SLC7A1,在体内和体外抑制SLC7A1后可抑制HCC细胞的生长。此外,精氨酸剥夺会引起HCC细胞发生综合应激反应,促进HCC细胞周期停滞并进入静止状态,这一过程依赖于GCN2(一般性调控阻遏蛋白激酶2)激酶活性。在精氨酸剥夺条件下抑制HCC细胞GCN2活性反而促进HCC细胞衰老,使HCC细胞对抗衰老药物敏感。临床前模型证明联合精氨酸剥夺饮食、GCN2抑制和抗衰老治疗可促进HCC细胞凋亡和肿瘤抑制。总之,这些结果表明靶向SLC7A1,或联合精氨酸限制、GCN2抑制和抗衰老治疗是人类肝癌治疗的新策略。
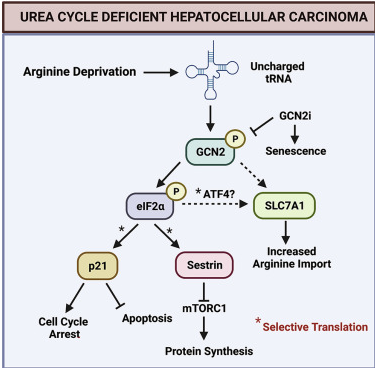
拓展阅读
GCN2 inhibition sensitizes arginine-deprived hepatocellular carcinoma cells to senolytic treatment
一作:RindertMissiaen PI:M. Celeste Simon
发表单位:Abramson Family Cancer Research Institute, Perelman School of Medicine, University of Pennsylvania
Abstract
原文链接:https://www.sciencedirect.com/science/article/pii/S1550413122002303

Cell Metabolism
3、铁在肝实质细胞-星状细胞之间的异常分布促使肝脏脂质生成和纤维化
肝脏铁异常分布——肝纤维化的罪魁祸首
中文摘要
肝实质细胞在肝脏铁稳态中具有重要作用,而铁稳态异常与肝脂肪变性和纤维化密切相关。本文中,研究人员发现NAFLD和NASH小鼠和人类肝脏中肝实质细胞的铁含量减少而HSC(肝星状细胞)铁含量显著增加。而肝实质细胞中铁的缺失可通过HIF2α-ATF4信号途径促进肝实质细胞脂肪生成和胰岛素抵抗。此外,正常情况下肝实质细胞分泌的含铁细胞外囊泡(EV)会被Kupffer细胞清除,而在NAFLD/NASH肝脏中由肝实质细胞分泌的含铁EV水平升高,导致肝实质细胞中铁的缺失以及HSC中铁超量。HSC中铁的积累促进活性氧大量产生,从而促进HSC纤维化;相反,抑制肝实质细胞EV分泌或者清除含铁EV可改善肝脏铁稳态,并缓解NAFLD/NASH的肝脏脂肪变性和纤维化。总之,这些结果表明铁的异位分布会促进肝脏代谢性疾病的发展。

拓展阅读
铁是人体必需的微量元素,成人体内约有35-45mg/kg的铁。铁元素参与众多生命过程,如氧气运输、电子链传递以及各式酶反应,有20%-30%的剩余铁储存在肝细胞中,因此肝细胞是铁元素的重要储存库以及铁稳态的调节器。有研究发现在APAP(乙酰氨基酚)诱导的急性肝损伤小鼠模型中,以花生四烯酸为主的n-6脂肪酸的脂质过氧化含量显著升高,诱导肝脏铁死亡现象,表明铁死亡是APAP诱导肝损伤的主要原因。近年来也有越来越多的临床研究发现铁在肝脏中的异位分布与NAFLD/NASH的发病率密切相关,但其分子机制还不清楚。本篇文章对其机制进行了探究,发现脂质显著增加了肝细胞分泌含铁的EVs(细胞外囊泡),而大量持续分泌含铁EVs导致肝细胞中铁匮乏,含铁EVs被临近的肝星状细胞吸收,导致肝星状细胞中铁过量,最终这两方面共同加速了肝脏脂质积累和肝纤维化进程。
Aberrant iron distribution via hepatocyte-stellate cell axis drives liver lipogenesis and fibrosis
一作:HongGao PI:Wei Ying
发表单位:Division of Endocrinology & Metabolism, Department of Medicine, University of California
Abstract
Hepatocytes have important roles in liver iron homeostasis, abnormalities in which are tightly associated with liver steatosis and fibrosis. Here, we show that non-alcoholic fatty liver disease (NAFLD) and steatohepatitis (NASH) are characterized by iron-deficient hepatocytes and iron overload in hepatic stellate cells (HSCs). Iron deficiency enhances hepatocyte lipogenesis and insulin resistance through HIF2α-ATF4 signaling. Elevated secretion of iron-containing hepatocyte extracellular vesicles (EVs), which are normally cleared by Kupffer cells, accounts for hepatocyte iron deficiency and HSC iron overload in NAFLD/NASH livers. Iron accumulation results in overproduction of reactive oxygen species that promote HSC fibrogenic activation. Conversely, blocking hepatocyte EV secretion or depleting EV iron cargo restores liver iron homeostasis, concomitant with mitigation of NAFLD/NASH-associated liver steatosis and fibrosis. Taken together, these studies show that iron distribution disorders contribute to the development of liver metabolic diseases.
原文链接:https://www.sciencedirect.com/science/article/pii/S1550413122003059
https://m.sciencenet.cn/blog-3483272-1363444.html
上一篇:代谢学人--Nature:U,执行A计划!线粒体UCP1/AAC机制大揭秘
下一篇:Nature近期代谢研究精选