博文
代谢学人--Nature:U,执行A计划!线粒体UCP1/AAC机制大揭秘
||
代谢学人
Nature:U,执行A计划!线粒体UCP1/AAC机制大揭秘
撰文 | 生茂正 郭文秀 高铭远 于剑
编辑 | 孟美瑶
校对 | 于剑

背景介绍
UCP1是在棕色脂肪中特异性且高度表达的一个线粒体内膜跨膜通道蛋白质,是棕色脂肪产热过程的最终效应分子。UCP1活化的时候,原本用于产生ATP的线粒体跨膜质子梯度由于UCP1解偶联的作用而“泄露”,“顺便”产生了大量的热。近年来,大量的研究发现众多以UCP1的mRNA和蛋白质丰度为最终作用目标的调控机制。但值得注意的是,棕色脂肪组织会随着年龄的增长而显著减少,而另一种产热蛋白:线粒体ATP/ADP转运蛋白(Mitochondrial ADP/ATP carrier, AAC)则突破了UCP1的这一限制,其在人体内的广泛表达使得其越来越受到人们的关注。
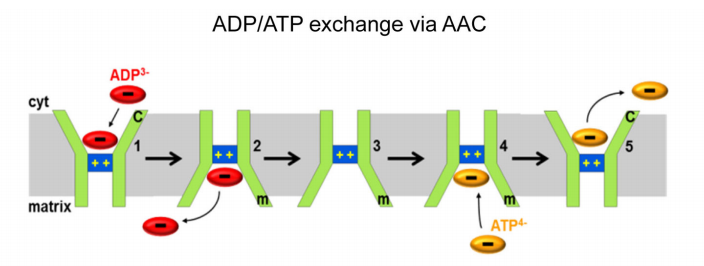
线粒体ATP/ADP转运蛋白(The mitochondrial ADP/ATP carrier, AAC)是存在于线粒体内膜的主要转运蛋白,它由6个跨膜α-螺旋组成,N端和C端均位于线粒体内外膜间空间,其单个底物结合位点(SBS)具有两种结构,朝向线粒体基质的M态和朝向细胞质基质的C态,因此它可以通过使SBS交替暴露于线粒体基质侧(M态)和细胞质基质侧(C态)的方式来交换细胞质基质中的ADP和线粒体基质中的ATP。此外AAC还介导了线粒体解偶联过程,有研究表明在不表达UCP1的组织中,AAC可以介导类似于UCP1介导的H+泄漏过程,AAC介导的H+泄露也需要FA。然而,与UCP1不同的是,在AAC易位途径中FA是作为一种辅助因子而不是共同运输底物,并且AAC可以通过ADP/ATP交换负向调节H+泄漏,但不完全抑制H+泄漏,这表明细胞对ATP的需求和ADP/ATP交换速率可动态控制H+泄漏和线粒体解偶联,通过介导ADP/ATP交换和H+泄漏两种传输过程,AAC紧密连接了线粒体中氧化过程和磷酸化过程的能量转换。
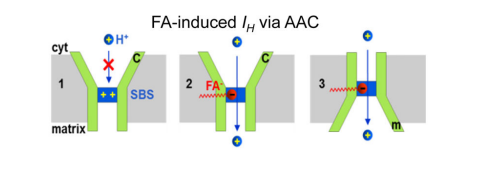
在线粒体中,H+在UCP1、ACC等蛋白的作用下,通过引发H+泄露( IH ),并穿过线粒体内膜(IMM)从而产生热量。因此,IH在引起产热、增加身体能量消耗和限制线粒体活性氧的产生中起到了重要作用,针对它的靶向治疗手段是解决代谢性和衰老相关疾病的核心。遗憾的是,通过AAC和UCP1筛选出来的IH小分子激活剂十分有限。此外,另一种可以引发IH的物质—游离长链脂肪酸(FAs)虽然可以起到较好的激活效果,但其选择性和生物利用度较差,难以作为药物使用。具有“膜溶性”的DNP和FCCP等质子载体(小编注:质子载体指可以促进质子穿膜,从而破坏质子跨膜梯度的物质,它们可以结合质子或者提高膜对质子的通透性,从而促进质子转运)可以通过自身的质子亲和性,同时通过去极化破坏线粒体膜的通透性,从而释放质子梯度。因此,目前普遍利用它们可以不通过膜运输蛋白穿膜且能够增加IMM的H+电导率的特性控制能量代谢。
也正是因此,DNP和FCCP已经成为在线粒体、细胞和系统水平上控制能量代谢的不可或缺的工具,然而这些质子载体往往具有较高的毒性,缺乏应用价值,且其机制也尚不完全清楚。近期,Yuriy Kirichok课题组在Nature上发表了题为“Mitochondrial uncouplers induce proton leak by activating AAC and UCP1”的研究成果,报道了这些常见的解偶联剂在线粒体中的作用机制并非仅是先前普遍认为的质子载体活性调控电导率,而是通过AAC和UCP1激活IH从而促进产热。

敲黑板啦!
研究结果
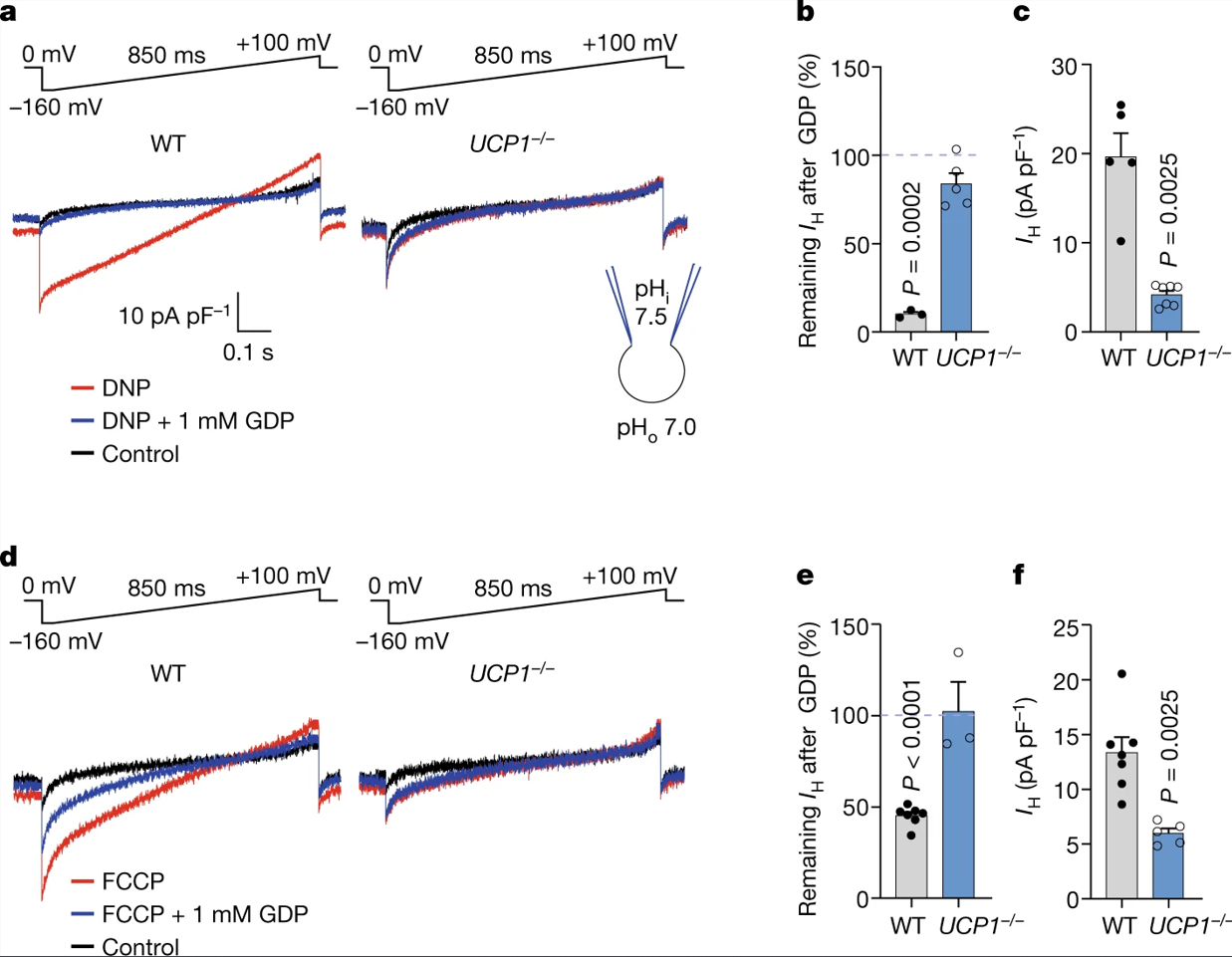
作者首先利用膜片钳技术,对由DNP和FCCP诱导线粒体内膜IMM(去除线粒体外膜)产生的IH进行检测和分析。将DNP和FCCP应用于线粒体外侧(即靠近胞浆的一侧)可导致高IH。相比之下,使用更高浓度的DNP和FCCP处理HEK293细胞质膜所产生的IH小得多(图1a-d)。对整个IMM中DNP和FCCP诱导IH的首次直接测量表明,IMM具有增强质子载体作用的独特能力,其原因可能是由于其独特的生物物理特性或存在特定的膜蛋白。
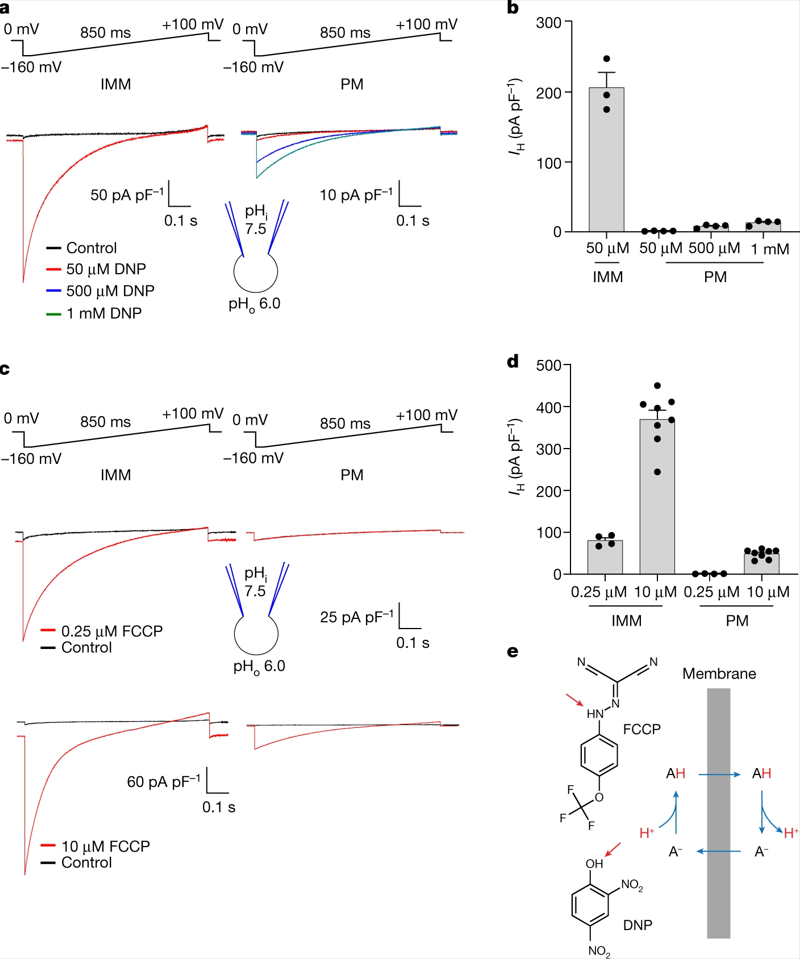
图1 | IMM 中 DNP 和 FCCP 激活的 H+电流与质膜的关系
2、质子载体通过AAC诱导IH
由于AAC在棕色/米色脂肪以外的组织中可诱导脂肪酸引起的线粒体IH,作者推测DNP和FCCP可能通过AAC激活IH。研究发现,DNP以剂量依赖性的方式诱导IH (图2a和图S1a)。AAC抑制剂羧基苍术苷(Carboxyatractyloside , CATR)可以抑制约60%的电流(图2a, c),而另一种AAC抑制剂米酵菌酸(Bongkrekic acid, BKA, )效果较差,仅有15%(图S1b)。(小编注:AAC具有两种结构,朝向线粒体基质的M态和朝向细胞质基质的C态,CATR抑制ANT的C态,BKA抑制M态)
小鼠体内有两种AAC亚型,即AAC1和AAC2,其中AAC1在心脏和骨骼肌中占主导地位。因此,在AAC1−/−小鼠心脏的IMM中,DNP诱导的IH降低约80%,且对CATR敏感性较差(图2b-e)。因此,DNP主要通过靶向AAC来激活IMM的IH。此外,DNP诱导的IH中存在约20%的ACC非依赖性成分(图2d,e),这可能与DNP对质子的活化(小编注:DNP本身可以对质子进行活化,使其能量上调,从而加速其穿膜或逃逸)以及对其他IMM蛋白的作用有关。
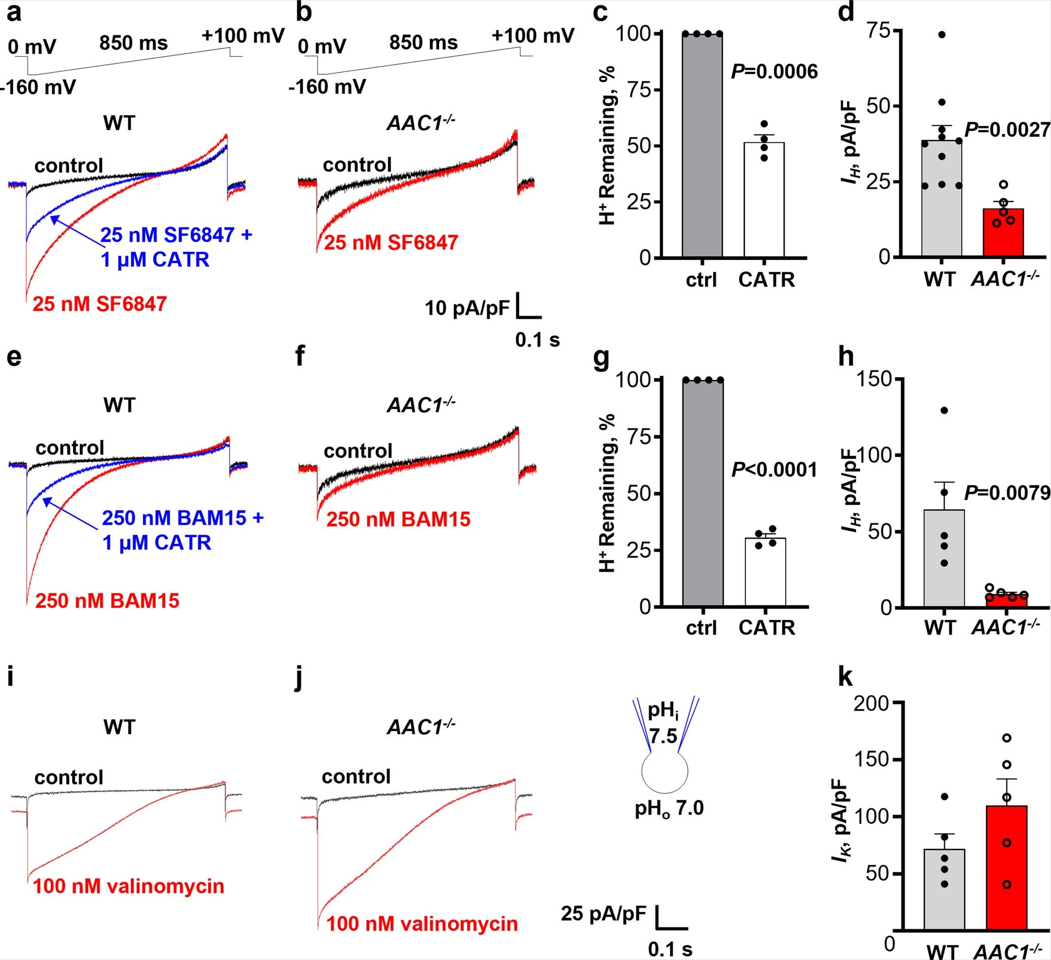
接下来,作者研究FCCP和其他线粒体解偶联剂是否也通过AAC诱导IH。结果发现,与之前的研究一致,在同样的浓度下FCCP,SF6847和BAM15比DNP更有效,并诱导了显著的线粒体IH (图2g和图S2a,e)。CATR对FCCP、SF6847和BAM15诱导的IH分别能够抑制约20%(图S1d,e)、50%(图S2a,c)和70%(图2e,g)。在AAC1−/−小鼠心脏的IMM中,FCCP、SF6847和BAM15诱导的IH也分别减少了约50%(图2f,g)、60%(图S2a,b,d)和85%(图S2e,f,h)。与解偶联剂诱导的IH相反,在AAC1−/−小鼠心脏的IMM中,通过K+选择性电离载体缬氨霉素激活的K+电流并没有减少(图S2i-k)。有趣的是,对于所有解偶联剂而言,AAC1缺陷对IH的影响比使用CATR的药物抑制效果更好(图2和图S1,S2)。这可能是由于CATR和解偶联剂之间存在对AAC结合位点的竞争,或由解偶联剂诱导的CATR不敏感的AAC状态(CATR仅与c状态的ACC结合)。
接下来,作者比较了野生型(WT)和AAC1/AAC2双敲除(DKO) C2C12细胞中分离的线粒体中解偶联剂诱导的呼吸速率。DNP和BAM15导致WT C2C12细胞线粒体的解偶联呼吸速率呈剂量依赖性增加,而DKO线粒体的解偶联呼吸速率显著降低(图S3a-f)。
作者还检测了FCCP、DNP和BAM15在WT和DKO C2C12细胞中诱导的解偶联呼吸,发现DKO细胞的基础呼吸速率明显低于WT细胞(图S4a),ATP合酶抑制剂寡霉素减少了WT细胞的呼吸,而在DKO细胞中没有发生改变。增加FCCP浓度后,WT和DKO细胞中的非偶联呼吸上调,但DKO呼吸速率仍较低,其速率稳定在每106个细胞约20 pmol s−1左右(图S4b),这表明DKO细胞的呼吸能力受到限制。使用缬氨酸霉素和黑霉素联合诱导ACC非依赖的线粒体解偶呼吸,进一步证实了DKO细胞的呼吸能力存在限制(图S4f)。虽然DKO和WT细胞中线粒体生物量和电子传递链复合物的表达总体上相似(图S3g-m),但DKO细胞中三羧酸循环活性或线粒体底物可用性的降低(其完全依赖糖酵解来产生ATP)可能会限制最大呼吸速率。
为了对WT和DKO细胞中解偶联剂诱导的呼吸作用进行有效比较,作者仅在低浓度的FCCP (100 nM到1 μM)、DNP (10 μM到250 μM)和BAM15 (500 nM到5 μM)中进行检测和分析,这些浓度不超过DKO细胞的呼吸能力(约为每106个细胞20 pmol s−1)。在DKO细胞中,由解偶联剂诱导的呼吸速率均出现下调,但与DNP和BAM15相比,FCCP对AAC的依赖性总体较低(图S4b-e),并与电生理数据呈良好的相关性(图2和图S2e-h)。此外,随着FCCP浓度的增加,FCCP诱导的呼吸对AAC的依赖性进一步降低(图S4e),其原因可能为质子载体成分的增加。相比之下,BAM15诱导的呼吸对AAC依赖性保持不变(图S4e),这可能是由于其有限的质子活性。
因此,除了其质子载体活性以外,广泛使用的线粒体解偶联剂如FCCP、DNP和BAM15可通过AAC激活IH。值得注意的是,与FCCP和DNP相比,BAM15对细胞和小鼠的毒性更小,这可能与其较低的质子活性和较高的AAC依赖性有关(图S4e)。
拓展阅读
线粒体氧化磷酸化是氧化作用(电子传递)和磷酸化(形成ATP)的偶联反应,当生物氧化与磷酸化偶联遭到破坏时,即发生解偶联现象。目前,解偶联剂已被广泛应用于线粒体能量代谢和产热研究中。
在结构上,解偶联剂主要分为化学解偶联剂和解偶联蛋白两种类型。当前研究中常见的化学解偶联剂包括有DNP (2,4-dinitrophenol, 2,4-二硝基苯酚)、FCCP (Carbonyl cyanide-p-trifluoromethoxy phenylhydrazone, 三氟甲氧基苯腙羰基氰化物)、SF6847(Tyrphostin9)和BAM15 ((2-fluorophenyl) {6-[(2-fluorophenyl)amino] (1,2,5-oxadiazolo[3,4-e]pyrazin-5-yl)}amine)等化学物质。这些物质可以使膜去极化,从而调节其通透性。同时,解偶联剂还可以充当质子载体,在线粒体膜间隙以解离形式存在并与质子结合变为脂溶性物质,从而透过线粒体内膜,在线粒体基质中解离释放H+。通过这种方式,解偶联剂将质子从线粒体膜外侧带入线粒体膜内侧,部分消除质子浓度梯度,将能量以热能的形式释放,并抑制ATP的形成。此外,还存在以蛋白形式发挥作用的解偶联蛋白,此类蛋白常为线粒体内膜蛋白,如在棕色脂肪组织中广泛分布的解偶联蛋白 UCP1和线粒体ATP/ADP转运蛋白 (Mitochondrial ADP/ATP carrier, AAC),UCP1具有的特定蛋白序列构成了线粒体载体通道门,可以介导线粒体胞质侧的质子回流到基质侧,降低线粒体膜电位,将质子浓度差产生电化学势能以热能形式释放。因此当敲除小鼠的UCP1基因时,其产热将会下降,同时对温度更加敏感。
参考文献:
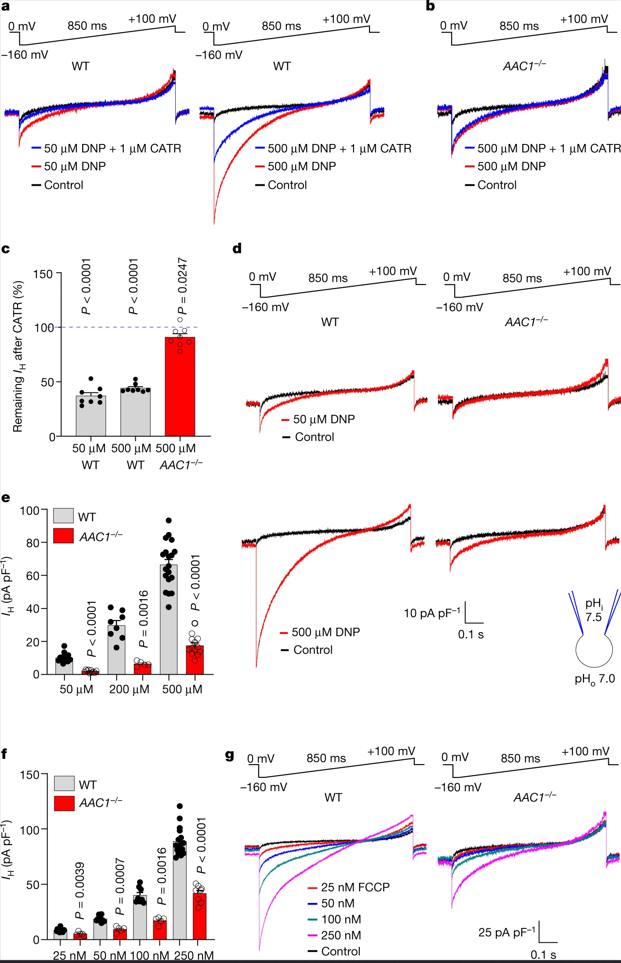
图2 | DNP和FCCP通过AAC激活IH
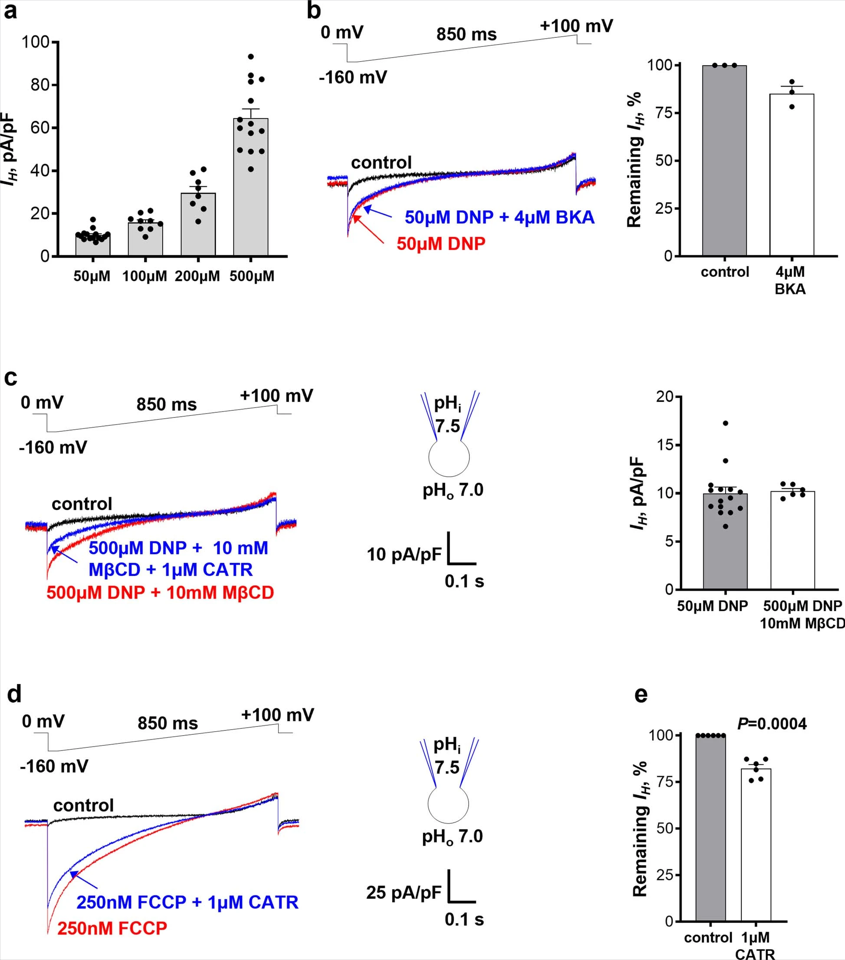
图S1 | DNP和FCCP诱导的线粒体IH
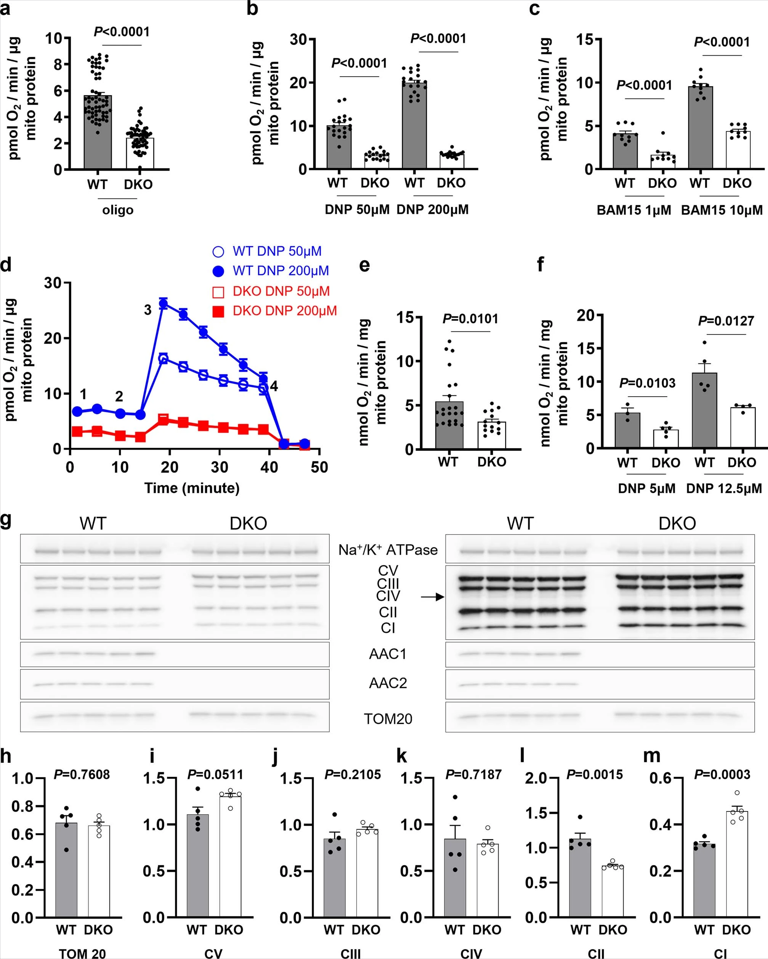
图S3 | DNP和BAM诱导的线粒体非耦合呼吸需要AAC

图S4 | 完整细胞中线粒体解偶联剂诱导的呼吸依赖于AAC
UCP1作为棕色和米色脂肪的主要解偶联蛋白,可能对这些组织中DNP和FCCP诱导的IH起作用。IMM相关的磷脂酶导致棕色脂肪IMM中产生大量内源性FA。因此,作者将DNP和FCCP与10mM甲基-β-环糊精(Methyl-beta-cyclodextrin, MβCD)联合使用,来提取内源性FA,从而限制FA对UCP1的影响(小编注:原文中提到,IMM上的磷脂酶可以促进大量的内源性FA在IMM中生成。而MβCD本身也可以与膜交换FA,但其亲和力弱于脂质膜。作者在这里使用了较高浓度的MβCD,从而促进了对其的螯合,同时,作者加入了DNP或FCCP改变了膜的通透性,从而更好地提取内源性FA)。在MβCD组中,作者使用了更高浓度的 DNP 和 FCCP(MβCD可以与疏水性化合物非特异性结合,并降低这些解偶联剂的有效浓度)例如,在10 mM MβCD存在下,500 μM的DNP在心脏IMMs中诱导的IH与50 μM的无MβCD的DNP诱导的情况相似(图S1c)。当使用500 μM DNP和10 mM MβCD后,棕色脂肪IMM中IH大幅上调(图3a(左))。这一现象在1 mM 5'-二磷酸鸟苷(Guanosine 5’-diphosphate, GDP, 一种已知的UCP1抑制剂)(图3a,b)或UCP1−/−的IMM中(图3a,c)被显著抑制。因此,UCP1在棕色脂肪线粒体DNP诱导的IH中至关重要。有趣的是,与心脏IMM中AAC携带的DNP诱导IH的内向整流电流-电压关系相比,UCP1携带的DNP诱导IH具有线性电流-电压曲线(图3a),这表明随着膜超极化,向内电流幅值急剧增加(图2a和图S1c)。在UCP1−/−棕色脂肪IMM中,残余IH向内矫正且对GDP不敏感(图3a,b),表明存在AAC的参与。
在棕色脂肪IMM中,FCCP诱导的IH也被GDP抑制,在UCP1−/−小鼠中更为显著(图3d,f),但残留在UCP1−/− IMMs中的IH对GDP并不敏感(图3f,e)。有趣的是,与DNP诱导的IH相比,FCCP诱导的IH对UCP1的依赖性更低(UCP1−/− IMMs分别减少约50%~80%;图3c,F),而与心脏IMM中FCCP和DNP诱导的IH对AAC的相对依赖性相似(图2e,f)。与DNP相比,FCCP对AAC和UCP1的依赖性更小,这是因为FCCP具有更高的质子活性或其他IMM蛋白的参与。
拓展阅读
UCP1作为棕色和米色脂肪的主要解偶联蛋白,可能对这些组织中DNP和FCCP诱导的IH起作用。IMM相关的磷脂酶导致棕色脂肪IMM中产生大量内源性FA。因此,作者将DNP和FCCP与10mM甲基-β-环糊精(Methyl-beta-cyclodextrin, MβCD)联合使用,来提取内源性FA,从而限制FA对UCP1的影响(小编注:原文中提到,IMM上的磷脂酶可以促进大量的内源性FA在IMM中生成。而MβCD本身也可以与膜交换FA,但其亲和力弱于脂质膜。作者在这里使用了较高浓度的MβCD,从而促进了对其的螯合,同时,作者加入了DNP或FCCP改变了膜的通透性,从而更好地提取内源性FA)。在MβCD组中,作者使用了更高浓度的 DNP 和 FCCP(MβCD可以与疏水性化合物非特异性结合,并降低这些解偶联剂的有效浓度)例如,在10 mM MβCD存在下,500 μM的DNP在心脏IMMs中诱导的IH与50 μM的无MβCD的DNP诱导的情况相似(图S1c)。当使用500 μM DNP和10 mM MβCD后,棕色脂肪IMM中IH大幅上调(图3a(左))。这一现象在1 mM 5'-二磷酸鸟苷(Guanosine 5’-diphosphate, GDP, 一种已知的UCP1抑制剂)(图3a,b)或UCP1−/−的IMM中(图3a,c)被显著抑制。因此,UCP1在棕色脂肪线粒体DNP诱导的IH中至关重要。有趣的是,与心脏IMM中AAC携带的DNP诱导IH的内向整流电流-电压关系相比,UCP1携带的DNP诱导IH具有线性电流-电压曲线(图3a),这表明随着膜超极化,向内电流幅值急剧增加(图2a和图S1c)。在UCP1−/−棕色脂肪IMM中,残余IH向内矫正且对GDP不敏感(图3a,b),表明存在AAC的参与。
在棕色脂肪IMM中,FCCP诱导的IH也被GDP抑制,在UCP1−/−小鼠中更为显著(图3d,f),但残留在UCP1−/− IMMs中的IH对GDP并不敏感(图3f,e)。有趣的是,与DNP诱导的IH相比,FCCP诱导的IH对UCP1的依赖性更低(UCP1−/− IMMs分别减少约50%~80%;图3c,F),而与心脏IMM中FCCP和DNP诱导的IH对AAC的相对依赖性相似(图2e,f)。与DNP相比,FCCP对AAC和UCP1的依赖性更小,这是因为FCCP具有更高的质子活性或其他IMM蛋白的参与。
参考文献:
无Mg2+的ADP和ATP(小编注:ATP/ADP可以与FA和DNP竞争性结合UCP1和AAC,从而抑制其功能。而Mg2+可以稳定ATP,改变ATP/ADP的解离常数等生化指标,从而使其无法发挥与FA竞争性结合UCP1的作用)是FA通过UCP1和AAC诱导IH的负调节因子,因此,作者假设解偶联激活的IH也被腺嘌呤核苷酸抑制。ATP通过500 μM DNP诱导的UCP1抑制IH,其半数最大抑制浓度(IC50)约为14 μM,而5 mM DNP诱导的IC50约为80 μM(图S5a)。该结果表明,ATP似乎和FA类似,可以与DNP竞争性结合UCP1。由于UCP1的核苷酸结合位点对ATP没有选择性,因此其他嘌呤核苷酸,如GDP(图3a)也通过UCP1抑制DNP诱导的IH。
与UCP1仅结合IMM胞质侧表面的嘌呤核苷酸不同,AAC运输腺嘌呤核苷酸并结合在IMM的两侧,其结合情况取决AAC的构象状态(c或m)。由于分离的有丝分裂体中绝大多数AAC蛋白最初处于c状态,核苷酸结合位点暴露在IMM的胞质侧表面,所以作者先将1 mM ADP仅应用于胞质溶液。此外,在实验中观察到了DNP诱导的IH有一个短暂且轻微的抑制(图S5b),可能是由于胞质ADP与AAC的c态结合,然后过渡到m态,并向基质侧释放ADP。在这种状态下由于移液器中没有ADP,ADP的转运由于梯度差可能变得畅通无阻,使DNP能够重新结合并引起IH恢复(图S5b)。
接下来,作者又将ADP加入到IMM两侧(小编注:作者在这里分离线粒体后进行IMM膜片钳实验,在膜片钳记录过程中,中空玻璃管(移液器)充满电解质溶液和连接到放大器的记录电极与隔离细胞的膜接触。另一个电极放置在围绕细胞的浴槽中作为参考接地电极。可以在记录电极和参考电极之间形成电路,从而进行测量。作者将浴槽作为胞质侧,而将移液器作为IMM侧。将两侧均加入ADP即认为为加入到IMM两侧),研究持续的核苷酸交换是如何干扰IH的。在实验中作者通过电中性ADP/ADP同质交换避免了ADP/ATP异质交换产生的电流对IH的干扰。在IMM的两侧添加1 mM ADP可导致DNP诱导的IH更强且持久的抑制(图S5c和图S5b)。这表明在持续的核苷酸交换过程中,核苷酸结合的AAC转运体中,DNP不能诱导IH,原因可能是核苷酸-DNP竞争或简单的易位通路阻塞。由于1 mM ADP处于生理相关的无Mg2+ ADP浓度的较高端,可以认为腺嘌呤核苷酸在生理条件下不能完全抑制DNP诱导的通过AAC的转运H+,但可以下调其转运效果。单侧和两侧用ADP对DNP诱导IH的抑制作用与FA通过AAC诱导IH的抑制作用相似,提示DNP和FA在与AAC和UCP1的中枢易位通路结合后诱导IH。
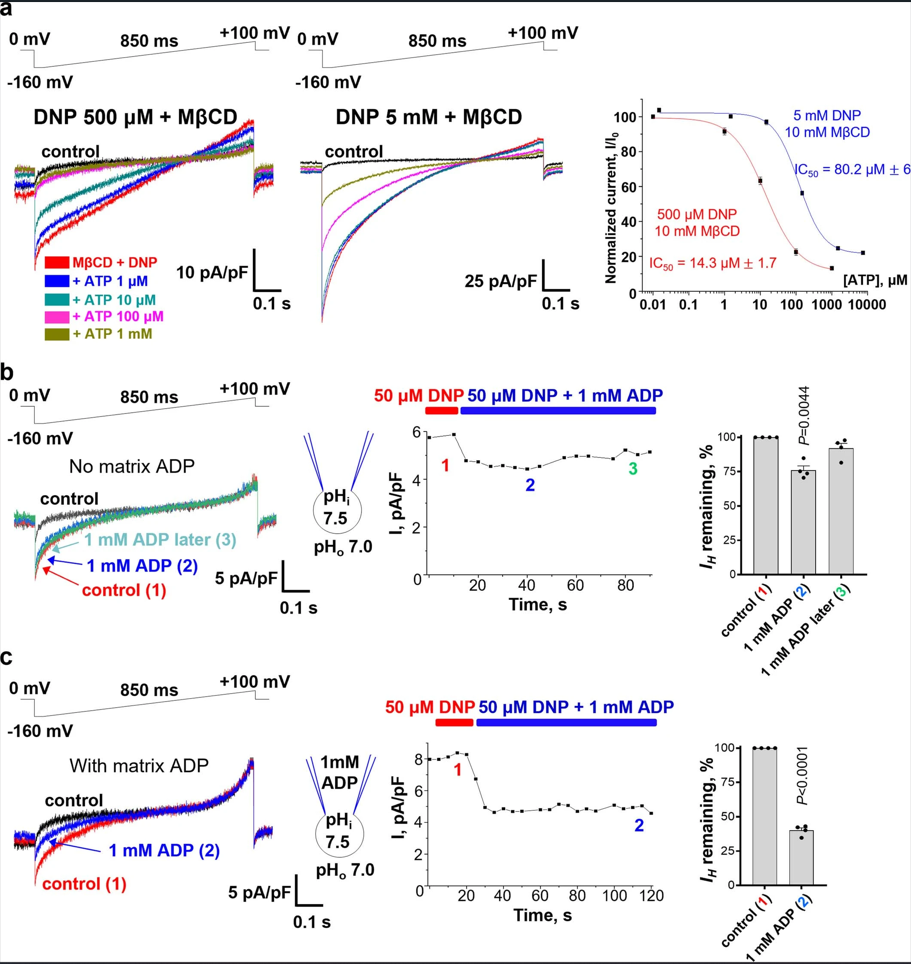
图S5 | 腺嘌呤核苷酸抑制DNP诱导的IH
5、解偶联剂和FAs结合在AAC中
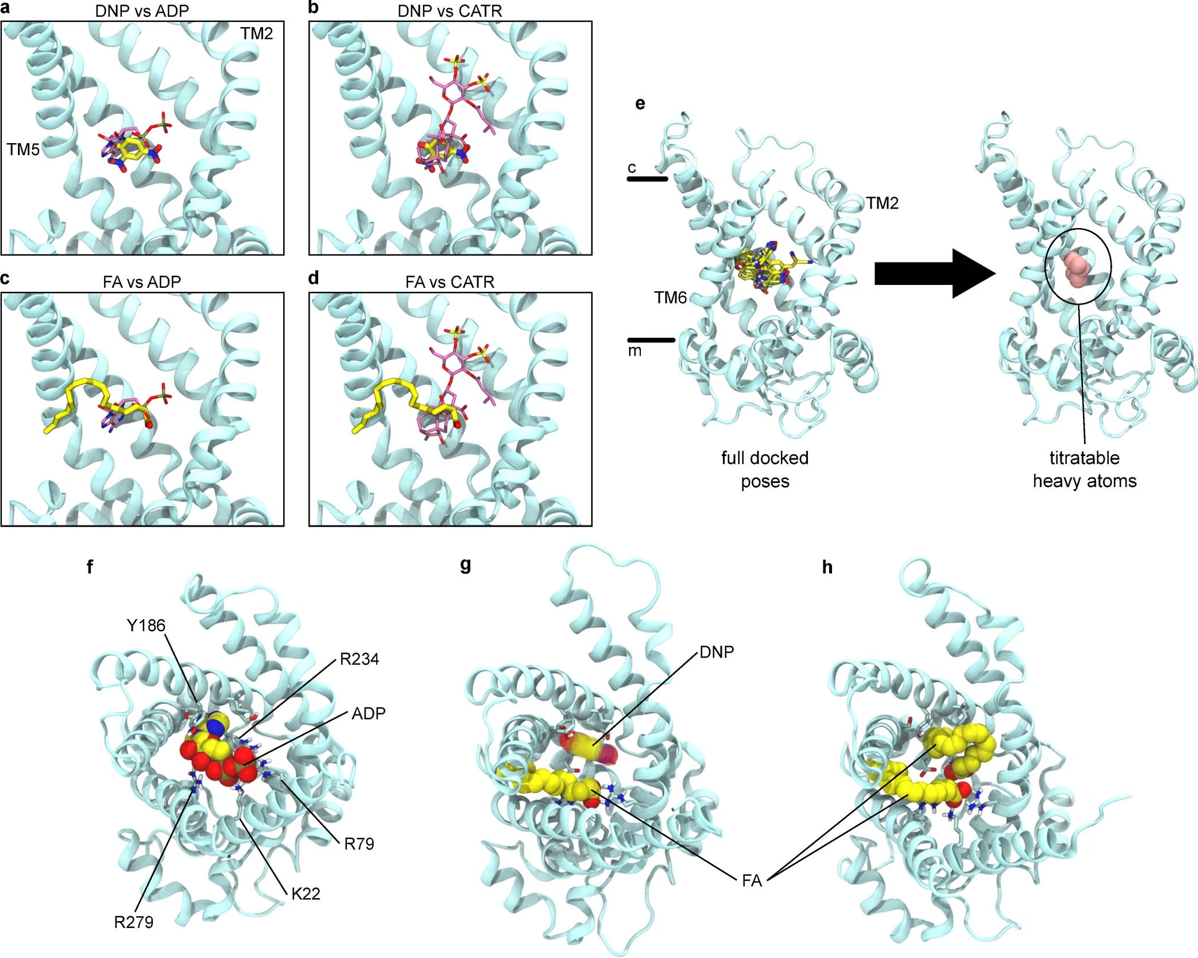
接下来,作者尝试通过硅对接和分子动力学模拟确定AAC中化学解偶联剂剂的假定结合位点。在介导IH的物质中,AAC是唯一的已被探明高分辨率结构的蛋白质。在c态时,AAC形成一个面向胞质侧的大的亲水性空腔,该空腔被晶体结构中的CATR所占据。先前的研究已确定其腔底为转运核苷酸的结合位点。在模拟中,作者通过针对牛AAC1 ((PDB): 2C3E)的整个空腔进行分子对接,并去除CATR分子。
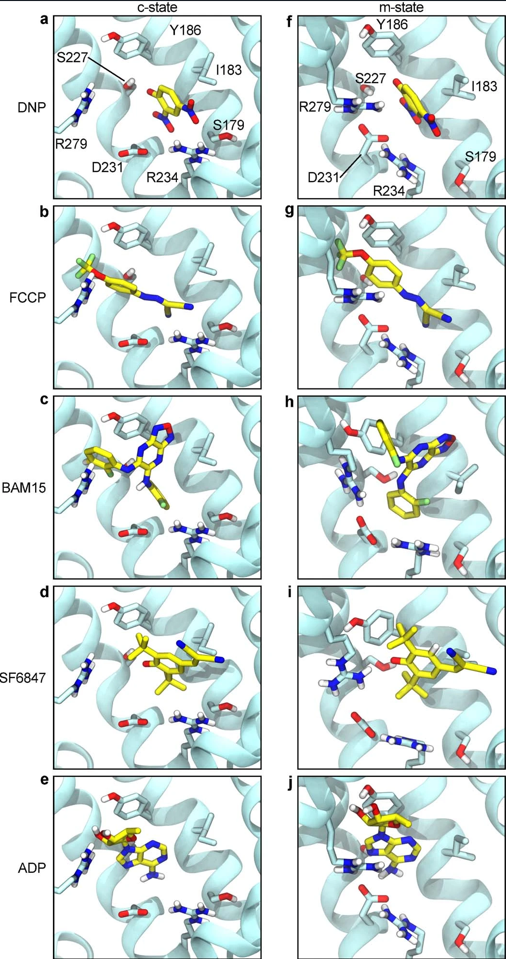
通过多次重复实验,作者在腔体深处(大约在IMM的中间)确定了DNP的结合模式,该模式不受化合物质子化状态的影响(图4a-c)。该位置的一侧具有高荷电,主要由碱性残基组成,但DNP聚集在另一侧疏水跨膜(Transmembrane, TM)螺旋4上。DNP的芳香族结构部分与疏水残基Ile183接触,并与Tyr186形成T型芳香堆积相互作用。此外,其中一个硝基与Arg234形成静电相互作用,而羟基则与Ser227形成氢键。在这个位置,DNP所占据的空间与ADP的腺苷环和CATR的二萜部分大致相同(图S6a,b)。
随后,在软件模拟将FCCP、BAM15和SF6487插入c态空腔中后,作者发现它们都结合在DNP识别的空腔中,且最佳结合模式保持在中性和负电荷态之间(图4c和图S7a-d)。尽管这些化合物具有不同的化学性质,但它们的结构在很大程度上是重叠的,因此所有四种分子上的关键可滴定原子都位于同一空间位置(图S6e),即其芳香环位于空腔的疏水侧。
利用基于最新的真菌AAC结构(PDB:6GCI)的牛转运体m态同源模型,重复了DNP和其他解偶联剂的对接。实验结果发现,m态的相互作用情况与在c-状态中观察到的非常相似(图S7),这一结果进一步证实了先前的推断,即胞质DNP可以与AAC的c-和m-状态结合激活IH(图S5b)。
为了验证这个位点,作者对c态AAC1进行了分子动力学模拟,将带电的DNP置于远离蛋白质的溶液中。在100 ns内,DNP在腔内强正电位的驱动下持续进入转运蛋白,并快速移动到对接后预测的位置(图4b,图S8A,b)。该位置的DNP是动态变化的,它会快速调整其羟基和硝基取代基团的方向,与不同的蛋白质基团相互作用,同时通过与蛋白质芳香环的接触,保持锚定在蛋白质上的单一位置。因此,接下来就需要针对已识别位点的DNP开始进行额外的模拟,在实验中使用-160 mV膜电位中的中性、质子化DNP或去质子化DNP,使负电荷偏向细胞质。在所有的模拟中,DNP在几乎整个500 ns的时间内都停留在原位置(图S8b-d),并在对接过程中观察到相互作用,以及与Arg79、Arg187和Asp231的在亲水界面的接触。
为了确定FAs是否具有与化学解耦因子所预测的位点一致的相互结合作用,作者进一步对14个处于c态和4个m态的AAC1进行分子动力学模拟。该实验将16个FAs(花生四烯酸或棕榈酸)随机放置在整个膜。在14个c态模拟中,有7个来自膜外层的FAs通过几种不同的路径进入腔体,而没有一个与m态结合。且其中存在两个不同模拟条件的花生四烯酸最初占据化学解偶位点超过1 μs (图S9a,b)。然而,在所有7个结合事件中,花生四烯酸和棕榈酸最终都占据了TM5和TM6之间的一个窗口区域并随即固定在那里。在大多数情况下,当羧酸盐与残基Lys22、Arg79和arg279相互作用时,酰基链会突出到脂质双分子层中,这些残基都被认为可以与核苷酸磷酸基相结合(图4d和图S6f和9c,d)。TM5-6的窗口区域在c态的x射线结构中则明显被水分子占据。酰基尾部区域固定在双分子层的构型为这一发现提供了物理基础,即长疏水尾巴对通过AAC和UCP12激活IH的FA至关重要。实验结果还表明,线粒体解耦联剂和FAs都在亲水的易位通路内结合,但其结合位点并不相同(图S6g)。解偶联位点与部分CATR结合位点和对接ADP的腺苷环重叠,而动态FA头部基团所占据的区域与CATR的羧酸基和ADP的磷酸基重叠(图S6a-d)。但遗憾的是,无法排除FA从解偶联位点而不是TM5/6窗口区域位点发挥作用的可能性,因为在模拟中两个位点均发现存在FA(图S9a-d)。此外,模拟结果还发现,在腔中放置两个FA(每个位置一个)也可以保持时长为微秒级的稳定(图S6h),表明c态可以同时容纳多个FA分子。以上实验说明FA和解偶联剂与AAC的结合位点具有重叠区域,因此存在竞争性结合的关系。
图S6 | CATR、ADP、小分子解偶联剂和脂肪酸的结合模式比较
图S7 | 对接揭示了小分子和核苷酸在AAC1的c和m态下的共同结合位点

图S8 | DNP在MD模拟中与AAC1的c态结合

图S9 | 脂肪酸通过TM5/6窗口区域与AAC1的c态结合
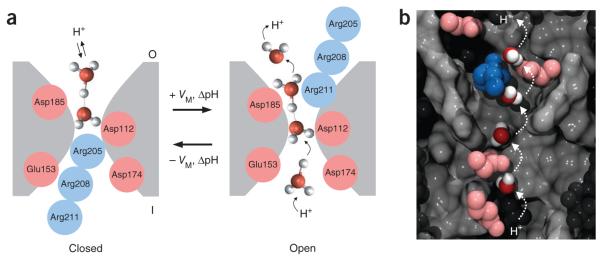
连续静电计算结果表明,存在一个巨大的正电位阻止H+进入AAC1的c态的胞质腔(图4e,f)。质子在靠近膜中心(z = 0)的空腔底部存在一个10 kBT的静电能势垒(Eelec),在此处能结合解偶联剂的质子化基团(图4e和图S6e)。在z = -5和-25 Å之间,并不存在可以通过基质侧封闭门的水通路(小编注:质子主要通过沿水线传递,水线是质子等小分子运输的主要形式。物质沿水线通过孔道蛋白的传递速率显著大于单纯的被动扩散。这里作者应该是想要说明不存在可以让质子通过的水通道、充水间隙和孔道蛋白)。因此,在这里存在另一个大的能量势垒(图4f)。存在于IMM中的负膜电位使能量分布向有利于H+进入基质的方向倾斜,但不会显著降低能量势垒(图4f和图S10a),这与缺乏FA或解偶联剂时通过AAC或UCP1缺乏IH的情况一致(图1)。
FAs和解偶联剂可能通过减少腔内的正电荷并提供一个可质子化基团作为垫脚石来实现H+的渗透,这一推论类似于为UCP1提出的FA-辅因子模型。然而,克服封闭基质门的能垒需要构象改变以打开H+向基质的渗透途径。这条路径应该很窄,以确保选择性的H+渗透,因此只需要很小的构象变化,而非ADP/ATP交换所需的完整的c态到m态转变。因此假设FA和化学解偶联剂均可以引起这种构象变化,该变化与存在低pKa的FA类似物时所记录的AAC(和UCP1)的瞬态预稳态电流变化一致。
在此基础上,作者建立了一个数学模型,检验解偶联剂结合和H+通往线粒体基质的选择性路径打开后,H+通过AAC渗透的可能性。在该模型中,质子首先从细胞质进入转运蛋白,并与解偶联剂(粉色分子)结合,随后过渡到狭窄的H+渗透通道,传递到基质(图4g)。H+通道的真实性质尚不清楚,因为它可能通过“水线”结构进行布朗扩散,转移到蛋白质上的可质子化位点或其他机制途径。因此,需要将这一步建模为阿伦尼乌斯速率,以便在这个粗略的水平上大致描述所有这些过程。
拓展阅读
水通道蛋白(Aquaporin,AQP),又名水孔蛋白,是一种位于细胞膜和质膜上的膜蛋白。这些蛋白在细胞膜上组成了各种孔道,用以控制水的进出。这种蛋白的发现,改变了人们先前普遍认为的水分子主要通过简单扩散的方式进行运输的观念。目前仅在人体中就发现了十多种AQP,这些蛋白主要可以分为两类:只选择性通过水分子的传统型水分子通道蛋白(Orthodox aquaporins)和允许水及其他小分子(如甘油)通过的水甘油通道蛋白(Aquaglyceroporins)。AQP的结构主要包括六个跨膜螺旋和五个连接环,他们共同组成了一个复杂的空间结构,确保仅水分子等物质可以选择性透过。
当AQP开启后,水分子在内部的偶极力与极性的作用下以适当角度快速通过孔道,完成跨膜运输。此外,水分子还可以与溶质通过氢键形成类似“水线”的结构,并以此介导质子和其他阳离子或小分子的跨膜传输。但与其他同样可以形成氢键“水线”的结构不同,AQP的质子通量显著低于水通量,这是因为当质子沿水链传递时,静电荷分布的改变和复杂的空间结构引起水分子重新排列旋转,局部氢网络进行优化,从而阻滞质子的膜转运。这些特性使得AQP在维持跨细胞和亚细胞膜的电化学梯度中发挥着重要的作用。另外,除了水通道外,其他一些狭窄的充水间隙也可以形成类似结构,使得质子可以在其中快速转运。
参考文献:
拓展阅读
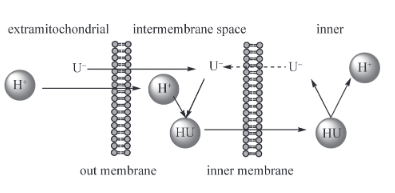
先前普遍认为,Hv1、AAC等质子通道蛋白主要是以天冬氨酸羧基的电离从而实现质子“穿梭”。但近来也有研究发现,这些质子通道或许还可以通过水分子实现穿膜运输的功能。这些质子通道的外侧常常含有大量水分子溶液。当孔道开放时,它们可以占据这些空腔,并在通道中形成一串连续排列的水分子。因此,部分溶质(如质子,单价离子等)可以与水分子以氢键的方式连接,形成被称为“水线”(Water wires)的的结构。目前已发现的质子传输途径绝大部分都是通过这种氢键水线的方式来传导的。与单纯的被动扩散相比,这种传输方式具有较高的传输速率和选择性。
参考文献:
[1] Bennett AL et al. J Physiol. 2017 Nov 15;595(22):6797-6799.
[2] Ramsey IS et al. Nat Struct Mol Biol. 2010 Jul;17(7):869-875.
根据基于结构的c态计算结果以及附加的生物物理考虑因素填充了模型中的速率。该模型预测在-160 mV下,当存在DNP类激活剂(溶液中pKa = 4.2)时,H+通量速率约为15 H+ / s,胞质和基质pH值分别为7和7.5(图4h)。大的正静电势垒(Eelec)是解释小单位电流通量的关键决定因素。即使将电势从10 kBT降低到6 kBT, IH也会增加8倍(图S10b)。因此,如果解偶联剂或FA引起的微小构象变化影响了胞质空腔的形状及其静电势,则会显著影响H+的输运速率。此外,同样的构象变化可以将解偶联剂或FA置于膜电场的更深处,这将增加H+从细胞质结合时通过的膜电压(f )的比例。f从0.1(计算值)增加到0.5会导致电流增加4倍(图S10b)。此外,f = 0.5的计算更接近实际实验轨迹中观察到的向内整流(图2和图S2)。
对解偶联剂的pKa进行调整,发现在pKa > 5时IH表现最强,而在pKa < 2时则不会产生电流(图S10d),这与先前发现的pKa数值较低的FA类似物在UCP1或AAC2中均不能诱导IH的情况一致。
最大的结构不确定性涉及H+从解偶联剂到线粒体基质的通路的性质。该模型对这过程的速率存在很大的限制(图4g中从状态2到状态3的转变)。这种转变必须发生在纳秒级或更快的范围内才能实现高效传导,否则由于腔内存在较大的正电位,H+将不能结合到细胞质(图S10e)。此外,该模型需假设IH对通道中H+的能量不敏感,这一假设的前提是解偶联剂的正向传递速率应与于许多质子渗透机制类似,处于较高的水平上。
该模型证明了解偶联剂诱导的H+通过AAC易位途径转运的可行性,复制了一些测量的电生理特性,并提供了一个基于分子的假说以推动未来的研究。


总结
该研究表明,线粒体解偶联物如DNP、FCCP、SF6847和BAM15等解偶联剂在IMM中主要通过激活AAC和UCP1来诱导FA依赖IH引起产热,而非先前普遍认为的质子载体对H+的调控。此外,解偶联剂和FA在诱导AAC和UCP1中的IH时存在共同点:均为弱酸、均结合在中央易位途径中,从而促进H+的结合和渗透。但也存在不同点:只有含有超过12个碳的长链FAs才能激活低浓度的AAC和UCP1依赖性IH,而解偶联剂则没有这一要求。这些结果可能为研发靶向这两种线粒体生物能量学中心新型、特异性激活剂铺平了道路。
关注微信公众号代谢学人
了解更多代谢前沿资讯

https://m.sciencenet.cn/blog-3483272-1359119.html
上一篇:代谢学人--Nature:笑一笑十年少,冻一冻肿瘤少
下一篇:代谢学人-Cell&Science&Nature近期代谢精选