博文
代谢学人--Cell Metabolism:储备粮草“脂质”与肿瘤增长的秘密
||
代谢学人
Cell Metabolism:储备粮草“脂质”与肿瘤增长的秘密
撰文 | 于柳 郭钰涵 武霞 陈俊桐 徐梓禾 邱瑾
编辑 | 孟美瑶
校对 | 郭钰涵

背景介绍
大约90%与实体瘤相关的死亡是远端器官肿瘤的转移性复发所致。在肿瘤转移过程中,DTCs(弥散性肿瘤细胞)的器官定植是一个低效且限速的过程,只有极少数的DTCs能够逃避强大的免疫监测,并在新的环境中生存,最终定植到远端器官。近来,肿瘤转移的研究取得了重大进展,主要揭示了DTCs和器官微环境之间复杂的相互作用。然而,目前这种DTCs-器官相互作用主要限制于细胞、转录和蛋白质水平上的研究,而器官微环境是否会对DTCs进行代谢调节仍是未知的。
在临床前癌症模型中,仅有部分证据支持器官微环境会对肿瘤细胞定植进行代谢调节。在乳腺癌肺转移模型中,DTCs会吸收肺间质液中富集的丙酮酸,启动代谢级联,通过促进α-酮戊二酸的生成激活胶原脯氨酰基-4-羟基化酶(P4HA) ,促进胶原蛋白的羟基化修饰,导致胶原蛋白稳定性增加,从而重塑细胞外基质,促进肺转移微环境的形成。靶向DTCs丙酮酸摄取可以使肺转移生态位中的异常胶原重塑正常化,抑制肿瘤细胞的迁移。在卵巢癌模型中,大网膜脂肪细胞合成的游离脂肪酸通过刺激FAO(脂肪酸氧化)为DTCs提供能量,或激活DTCs中的生存和增殖相关信号通路,从而促进卵巢癌向大网膜转移(小编注:大网膜是连接于胃大弯和横结肠之间的腹膜皱襞,自胃大弯向下呈围裙状遮盖在小肠、结肠等脏器前方。主要由多孔的半透明膜状区域和富含血管的脂肪组织区域构成。大网膜与胃癌、结直肠癌及卵巢癌等多种恶性肿瘤的腹腔内播散及复发密切相关)。以上实例表明器官环境支持DTC定植进行代谢调节的新作用。
肺是实体瘤远端转移器官中最常见的部位之一。以往研究表明,肺部微环境中浸润的固有免疫细胞的中性脂质积累可以促进实体瘤转移,有助于形成转移前的微环境。本实验中研究者发现肺MCs(间充质细胞)在正常和荷瘤状态下都表现出高水平的细胞内TG(甘油三酯)含量。在脂肪成纤维细胞(肺MCs中的一种)中,TG可以保护肺泡免受氧化损伤,并在肺泡发育过程中为肺表面活性物质(肺泡细胞分泌的脂蛋白)的合成提供底物。然而,MCs来源的中性脂质在病理过程中的作用仍不清楚。本实验中研究者利用乳腺癌小鼠模型研究肺MCs通过中性脂质代谢调节乳腺癌肺转移的机制。

敲黑板啦!
1、肺MCs(间充质细胞)在乳腺癌发生发展过程中储存中性脂质
2、IL-1β诱导中性脂质在MCs中积聚以促进转移
3、含脂的MCs代谢重编程肿瘤细胞和NK细胞
4、靶向IL-1β和含脂的MCs提高了基于NK细胞的免疫治疗的疗效
研究结果
1. 肺MCs在转移前阶段积累中性脂质
作者前期研究发现,肺浸润性中性粒细胞可积累中性脂质并促进转移,为了进一步了解肺部微环境积累的中性脂质在调节转移定植中的作用,作者比较了肺中主要细胞的胞内TG水平。有趣的是,在正常和AT3荷瘤的小鼠体内CD140a+ MCs内的TG水平均高于其他肺细胞(图1A)。此外,根据已发表的脂质组学数据集分析,作者发现人类肺MCs也含有高水平的TG,尤其是短链饱和或单不饱和TG(图S1A)。在不同的小鼠乳腺癌模型中,在转移前阶段的肺MCs中均检测到中性脂质水平升高(图1B-1D)。因此,肺MCs在癌细胞定植肺之前就开始积累中性脂质。
为了确定肿瘤引发的原发性脂质变化是否发生在特定的MCs亚群中,作者对CD140a+ MCs进行了scRNA-seq(单细胞测序)(图1E[左]),利用无偏聚类算法确定了三个主要的MC亚群(图1E[右])。根据表面标志物和最近发表的肺MC scRNA-seq数据集,作者发现这三个MCs亚群类似于外膜成纤维细胞(簇0)、肺泡成纤维细胞(簇1)和支气管周围成纤维细胞(簇2)(图S1B和S1C)。接着作者又依据表面标志物Ly6a和CD82进一步分离了这三个亚群(图1F)(图S1D)。虽然原发肿瘤生长会促进以上细胞亚群的转变(图1E和1F),但在这三个肺MCs亚群中均检测到胞内中性脂质水平升高(图1G)和脂质代谢途径富集的现象(图S1E)。此外,这三个MCs亚群所在的微观解剖位置(图S1F)—体外间隙、肺泡间隙和支气管周围间隙也进一步支持了以上三个MCs亚群类似于外膜成纤维细胞(簇0)、肺泡成纤维细胞(簇1)和支气管周围成纤维细胞(簇2)这一观点。此外,在小鼠内富含脂肪的成纤维细胞CD90+ 肺MCs和CD90- 肺MCs中都发现了肿瘤诱导的中性脂质积聚(图S1G)(小编注:CD90也称为Thy-1,是鉴别人类MSCs的重要标记之一,大于或等于95%的MCs表达CD90,所以这类细胞应该是包含前面提到的那3簇细胞的,这里想说的是几乎所有MCs都发现了肿瘤诱导的中性脂质积累)。
与肺MCs不同,CD140a+ MCs还存在于其他组织和器官,包括心脏、脑、骨、肝、肾(图1H、1I和S1H),以及原发性乳腺肿瘤(图1J、1K和S1I)。在AT3或4T1肿瘤小鼠模型中,随着原发性肿瘤的发生发展,其他器官的CD140a+ MCs内中性脂质含量都没有明显升高。总之,在转移前阶段,荷瘤导致CD140a+ MCs在肺内积聚中性脂质,而且可能不只局限于特定MCs亚群(小编注:本文发现三个肺MCs亚群中均检测到了胞内中性脂质水平升高,并且CD90+肺MCs和CD90 -肺MCs中也都发现了肿瘤诱导的中性脂质积聚,所以说不局限于特定的亚群)。

图1. 肺MCs在转移前阶段积累中性脂质
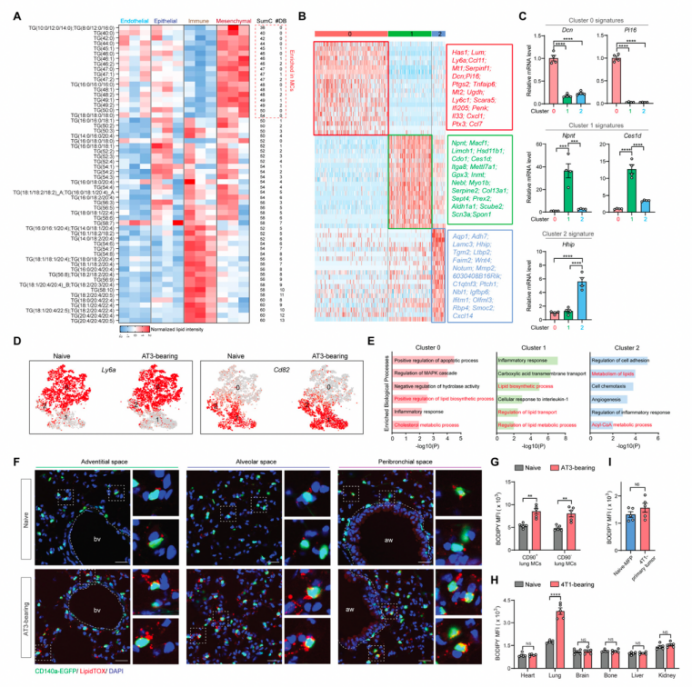
附图1 肺CD140a+MCs的scRNA-seq结果
2. IL-1β诱导中性脂质在MCs中积聚以促进转移
先前研究发现,原发肿瘤或宿主源性因子会触发肺转移前微环境的形成,这是实体瘤转移的必要准备步骤。然后,作者对先前报道的转移前微环境调节因子进行了体外筛选,发现IL-1β(白介素-1β)是刺激肺MCs中性脂质积聚的最有效的一类调节因子(图2A)。此外,在AT3(图2B)和MMTV-PyMT(图S2A)肿瘤小鼠模型中,在转移前阶段的循环和肺组织中也确实检测到了IL-1β(小编注:MMTV-PyMT模型小鼠是在小鼠体内采用乳腺特异性启动子定向表达癌基因。其中乳腺特异性启动子多采用MMTV-LTR,MMTV是导致小鼠乳腺肿瘤的重要病毒,研究人员将其病毒组织特异启动子及增强子功能剥离出来以介导PyMT等癌基因在乳腺中高表达,进而诱发乳腺癌)。
IL-1β主要是髓系细胞在炎症过程中产生的,并且当荷瘤小鼠肺部CD11b+髓系细胞浸润增加,IL-1β也会增加(图2C)。这种肿瘤诱发的髓样细胞浸润可能是肺组织特异性的(图S2B),并且肺内髓样细胞的分布并不特定于某些显微解剖位置(小编注:髓样细胞分布包含前面所说的三类含脂MCs的三个解剖位置,但并不特定于这些位置。免疫染色结果显示髓样细胞和CD140a+ MCs空间上接近,表明髓样细胞来源的IL-1β可以作用MCs,但并不是髓样细胞只存在于特定MCs位置上)(图S2C),这与含脂的MCs的组织特异性和肺内空间分布密切相关(图1H和S1F),这表明可能存在髓样细胞-IL-1β-含脂的MCs轴。髓样细胞与肺MCs空间上的接近也进一步支持了这一观点(图S2D)。除髓系细胞外,肿瘤细胞来源的IL-1β也可以刺激肺MCs脂质储存(图S2E-S2G),此外,肿瘤细胞来源的CCL-2 (C-C 基序趋化因子配体2)可以诱导髓系细胞中IL-1β的表达(图S2H-S2J)。为了响应IL-1β细胞因子的高表达,荷瘤小鼠的肺MCs中还会诱导一系列编码IL-1β的下游信号分子的基因的表达(图S2K)。因此,髓系细胞和肿瘤细胞来源的IL-1β可能有助于肺MCs的脂质储存。
紧接着,作者进一步鉴定了IL-1β在赋予肺MCs载脂表型的作用。在体外实验中,IL-1β刺激肺MCs积累中性脂质(图2D),而如果肺MCs缺乏Il1r1(白细胞介素1受体1型)则会消除这种作用(图2E和S2L)。在体内,直接注射IL-1β可有效诱导肺MCs中性脂质升高(图2F)。在AT3或4T1模型中,宿主Il1r1缺乏或IL- 1b中和会降低肺MCs的负载脂质的程度(图2G、H和图S2M)。此外,作者发现,肺MCs中IL-1β诱导的脂质积聚可能与小鼠遗传背景无关(图S2N),而且在人肺MCs中IL-1β也能发挥类似的功能(图2I和2J)。总的来说,IL-1β是乳腺肿瘤发生发展的关键因素,引发肺MCs内中性脂质储存。
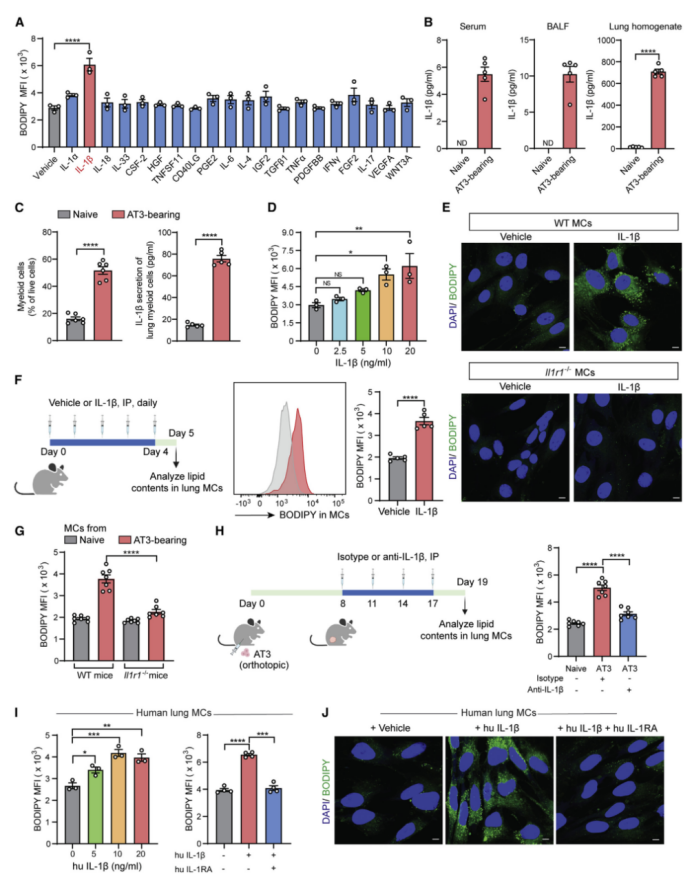
图2 IL-1β诱导肺MCs中性脂质积聚
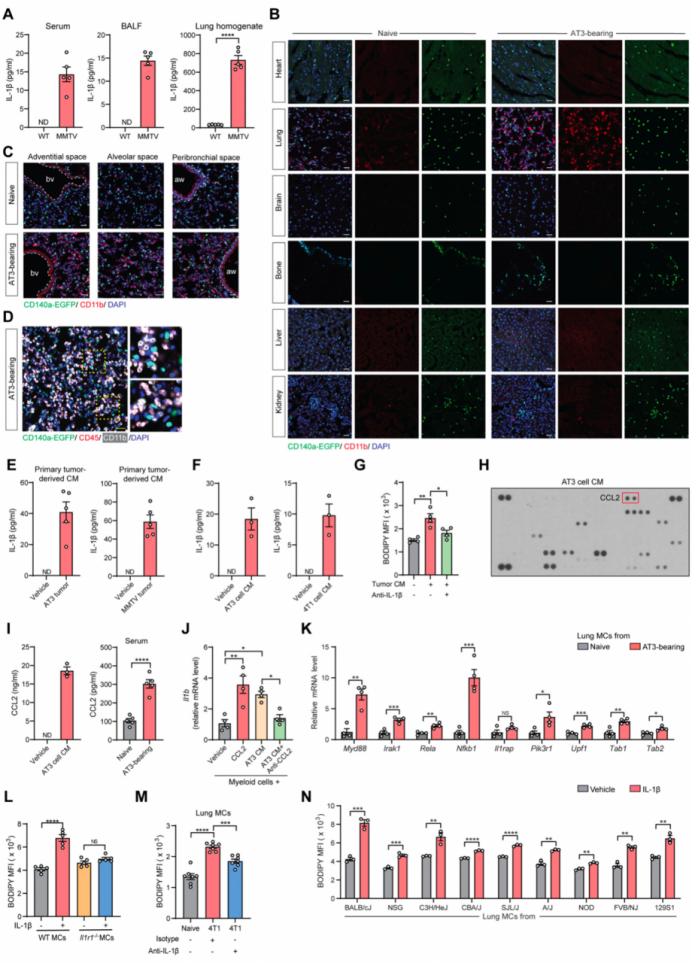
附图2 IL-1β诱导肺MCs脂质积聚
3. IL-1β诱导的肺MCs中脂质积聚与HIF1A-HILPDA-ATGL的级联作用
TG脂解异常在哺乳动物细胞内中性脂质积累的驱动机制中起着关键作用。作者发现,在荷瘤状态下,转移前阶段肺MCs的TG脂解这一生理过程被抑制(图3A和S3A),而IL-1β会抑制TG脂解,导致TG在肺MCs中积聚,这一过程因IL-1R1缺乏而完全消失(图3B)。因此,TG脂解失败可能是IL-1β~IL-1R1信号驱动肺MCs中性脂质积聚的主要原因。
催化TG脂解的酶主要有三种:ATGL(脂肪甘油三酯脂肪酶)、HSL(激素敏感脂肪酶)和MGL(单甘油三酯脂肪酶)。其中ATGL酶解过程是第一个限速步骤,与脂滴动力学密切相关(图3C[左])。此外,编码ATGL的基因(Pnpla2,在此称Atgl)在肺MCs中表达水平更高(图3C[右]),在TG脂解过程中比其他两种酶发挥更重要的作用(图3D)。接下来,作者又进一步研究了荷瘤状态下IL-1β是否可以调节ATGL或其抑制因子—HILPDA(缺氧诱导脂滴相关蛋白)、G0S2(G0/G1开关基因2)和CIDEC(细胞死亡诱导DFFA样效应物C)的表达。通过RNA-seq筛选和进一步验证,作者发现IL-1β并未改变Atgl的表达(图S3B),但却上调了HILPDA的表达水平(图3E, S3B和S3C);而另外两个ATGL抑制因子G0s2和Cidec在肺MCs中要么被IL-1β诱导下调,要么未被检测到(图S3B)。为了确定HILPDA是否为连接IL-1β与肺MCs中TG积累的关键因素,作者构建了CD140a+ MCs特异性HILPDA敲除(KO)的小鼠模型(HilpdaΔMCs),发现HILPDA敲除后能消除IL-1β诱导的肺MCs内脂解抑制和中性脂积聚的现象(图3F)。在IL-1β处理后,肺MCs释放TG的水平下降(图S3D),减少了肺MCs中原发性肿瘤驱动的中性脂质储存(这里指IL-1β处理后的HILPDA敲除小鼠中肺MCs释放TG的水平下降,HILPDA敲除小鼠促进脂解,本身TG水平下降,导致MCs 释放以及储存的TG减少)(图3G)。总之,HILPDA对于IL-1β或肿瘤诱导的含脂肺MCs的形成具有重要作用。
HILPDA是一类调节胞内脂质储存的缺氧诱导蛋白。在IL-1β处理后,肺MCs中确实产生了HIF1A(缺氧诱导因子1- α)(图3E, S3B和S3C),这可能不是由NFkB(核因子κ B)激活或HIF1A蛋白稳定性增加引起的(图S3E和S3F)。缺乏Hif1a的肺MCs中HILPDA的表达水平下降(图3H), 而通过IOX4直接激活Hif1a可诱导肺MCs中HILPDA的表达和脂质积累(图3I)。此外,在人MCs中,HIF1A~HILPDA信号也能响应IL-1β的刺激促进中性脂质积聚(图3J, 3K和S3G)。
除了Hilpda,某些与脂质吸收和脂滴形成相关的基因也会被IL-1β诱导表达(图S3H),这表明其他被IL-1β刺激的脂质代谢途径也可能有助于含脂MC的形成。另一方面,IL-1β还会抑制肺MCs中与β-氧化相关的基因的表达(图S3I)。相一致的是,作者发现IL-1β处理后的肺MCs的氧化磷酸化水平低于对照MCs(图S3J),这表明在IL-1β处理后,MCs代谢转向脂质储存。总之,肿瘤相关炎症通过IL-1β~HIF1A~HILPDA轴形成含脂的肺MCs,抑制TG脂解使得TG积累(图3L)。
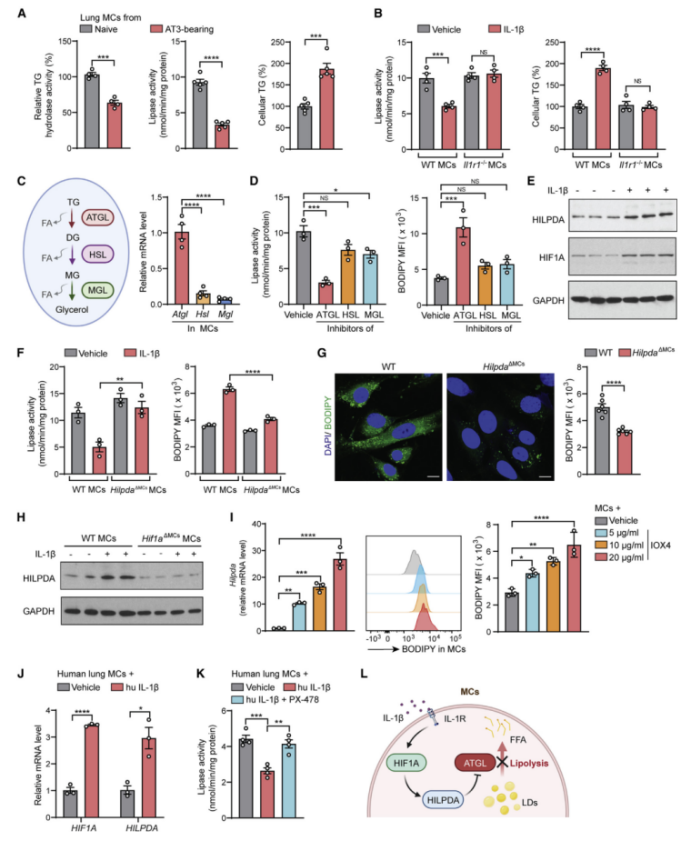
图3 IL-1β诱导的肺MCs中脂质积聚HIF1A-HILPDA-ATGL的级联作用
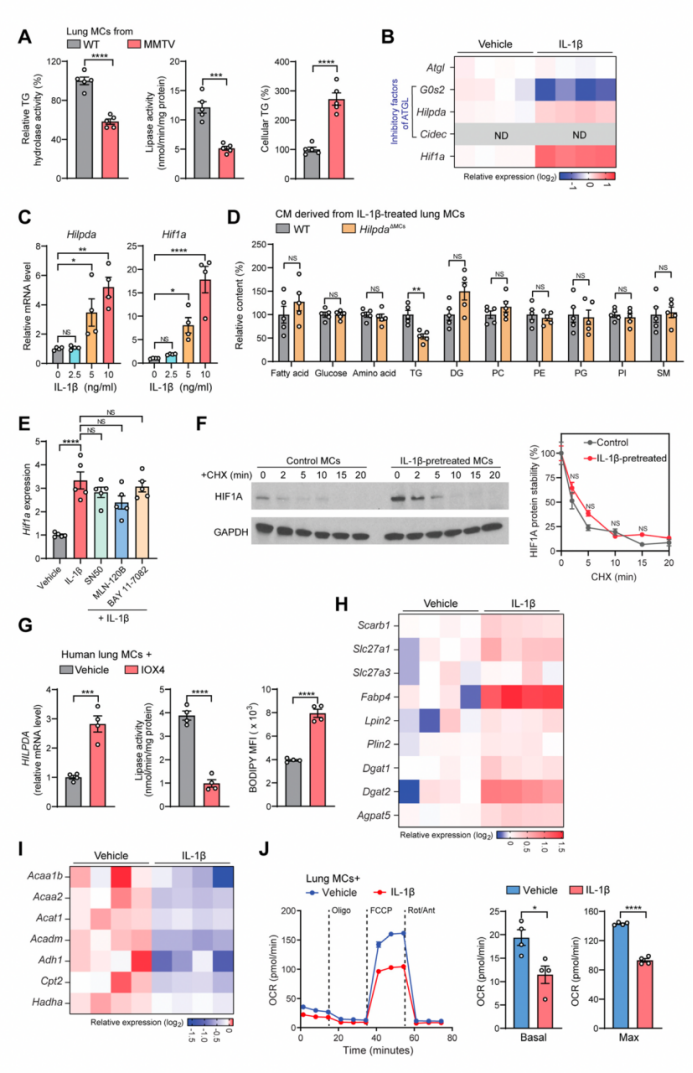
附图3 IL-1β通过HIF1A-HILPDA-ATGL轴诱导脂质积累
拓展阅读
脂肪酸通过几种脂肪酸转运体进入细胞,脂肪酸结合蛋白会引导脂肪酸到达不同的代谢目的地。除了氧化作用外,脂肪酸的一个重要代谢命运是储存。大多数类型的细胞可以将多余的脂肪酸转化为甘油三酯来储存。甘油三酯在内质网中合成,并储在脂滴中。与大多数其他细胞器相比,脂滴是非常动态的,可以根据细胞需求快速扩张或收缩。甘油三酯的合成、在脂滴中的沉积以及随后将甘油三酯分解为脂肪酸的过程由一组复杂的酶和脂滴相关蛋白调控。这些脂滴相关蛋白在脂滴中起着结构性作用,并调节关键的脂肪生成酶和脂肪分解酶的活性。一组重要的脂滴相关蛋白是perilipin家族的成员,包括PLIN1-PLIN5。其他脂滴相关蛋白包括CIDEA、CIDEB、CIDEC、FITM1、FITM2、G0S2、ABHD5和HILPDA。
脂滴相关蛋白本身在蛋白和基因表达水平上受到多种调控机制的影响。过氧化物酶体增殖激活受体(PPARs)在脂滴相关蛋白的转录调节中起关键作用,并且在脂滴重塑参与脂肪生成酶和脂解酶的调节中起关键作用。PPARs的配体包括一系列外源性和内源性脂质,包括各种脂肪酸,以及大量的合成化合物。这些脂质细胞内浓度的变化可以影响PPARs依赖的基因调控。PPARα调节许多基因的表达,这些基因几乎涉及肝脏脂质代谢的各个方面,包括许多编码脂滴相关蛋白和脂质生成酶和脂质分解酶的基因。
参考文献:
[1] M. A. de la Rosa Rodriguez and S. Kersten.Biochim Biophys Acta Mol Cell Biol Lipids. 2017.
CIDE家族蛋白
CIDE家族蛋白包括Cidea、Cideb和Cidec/Fsp27,人们根据其与DNA片段因子40/45 N端结构域的同源性进行命名(DFF40/45)。一系列的基因研究发现,CIDE家族蛋白调节代谢组织和分泌腺体中的代谢活动。学者对Cidea−/−小鼠的首次研究表明,Cidea调节棕色脂肪细胞的脂质储存和降解。在随后的十年中,一系列CIDE缺陷小鼠研究或CIDE蛋白过表达实验表明,CIDE是各种脂质代谢信号通路的关键调控因子,参与调控脂质储存、分泌和合成。
三个CIDE成员的表达和分布具有组织特异性。Cidea在小鼠BAT和人类WAT中大量表达,同时,在乳腺、皮肤中的皮脂腺和睑板腺中也有表达。Cidea的表达与这些组织中的脂质储存和脂质分泌高度相关,Cidea−/−动物能够抵抗HFD诱导的肥胖、乳脂质减少和干燥的皮肤和头发。Cideb主要在肝脏中表达,而在肠道中几乎不表达,它的缺乏会导致脂质代谢途径的各种缺陷。Cidec主要在WAT中表达,在BAT中也表达。总之,CIDE蛋白定位于内质网和脂滴(LDs),并调节脂质稳态。Cidec作为一个脂滴表面蛋白,它的表达与脂肪细胞分化相关,Cidec可能通过抑制脂肪的分解,促进脂滴的成熟,从而参与了脂肪细胞的分化过程。如果抑制了Cidec的表达,可阻止脂肪细胞的分化,防止肥胖的发生,因此Cidec有望成为治疗肥胖的新靶点。总之,CIDE蛋白定位于内质网和LDs(脂滴),并调节脂质稳态。
参考文献:
[1] Chen, Feng-Jung et al. Traffic (Copenhagen, Denmark). 2020.
4. 含脂MCs可促进转移性定植
为了确定含脂MCs在肺转移过程中的作用,作者构建了AtglΔMCs小鼠。在明确了AtglKO的细胞特性(图S4A)后,作者发现与荷瘤或经IL-1β处理相似,肺MCs特异性Atgl敲除小鼠也表现出TG脂解终止、细胞内TG升高(图4A)和中性脂质积聚(图4B和4C)等现象。此外,离体培养条件下AtglΔMCs肺MCs比WT MCs释放更多TG(图S4B)。因此,AtglΔMCs模型和上述HilpdaΔMCs模型分别代表增强的和衰减的含脂MCs表型,为下一步的功能分析提供了基础。
作者利用上述两类转移定植模型来评估转移前微环境的作用(图4D[左]),结果发现AtglΔMCs小鼠的AT3肿瘤细胞肺定殖水平高于WT小鼠(图4D[中和右]);而HilpdaΔMCs小鼠的转移定殖水平降低(图4E)。但Atgl条件敲除(cKO)和Hilpda cKO均未影响原发AT3肿瘤的生长(图4F和4G),这就表明含脂MCs在肺微环境中具有特殊作用。此外,作者还进一步研究了含脂MCs在自发肺转移模型中的功能作用(图4H[左]),该模型能更好地模拟原发肿瘤切除但转移灶保留完整的临床环境。结果发现Atgl cKO小鼠的自发肺转移水平持续升高(图4H[中、右])。最后,宿主Atgl cKO还会导致MMTV-PyMT模型中自发性肺转移增加(图4I)。因此,含脂肺MCs有助于乳腺癌向肺转移。
此前有报道称,HILPDA通过抑制ATGL形成脂滴以维持癌细胞在缺氧条件下的存活(小编注:有研究表明,在缺氧条件下的各种癌细胞中,HIF-1激活后可通过其下游靶点HIG2(缺氧诱导基因2)下调由ATGL介导的脂滴分解代谢,使脂滴积累,从而抑制脂滴中的FAs进入线粒体氧化和ROS的生成途径,抑制癌细胞的凋亡,进而维持癌细胞在缺氧条件下的生存),因此作者对HILPDA或ATGL cKO是否能作为调控转移的机制影响MC细胞的存活进行了探究。在体外IL-1β处理和体内荷瘤的条件下,HILPDA或Atgl缺乏均未改变MC细胞存活或凋亡的情况(图S4D-S4F),这表明含脂MCs与肺微环境细胞之间发生相互作用进而直接调控转移。因此,作者对载脂MCs如何在肺转移微环境中调节肿瘤细胞和宿主细胞进行了研究。
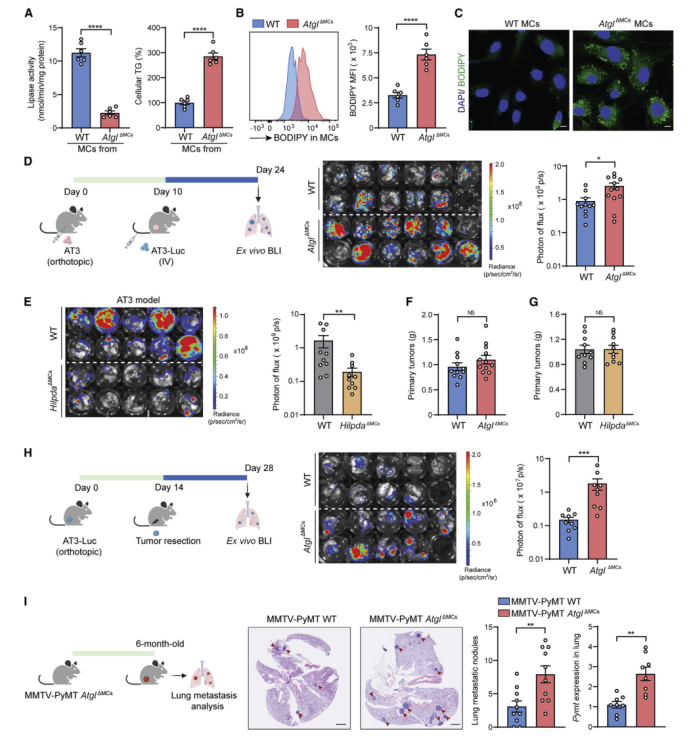
图4 含脂MCs可促进转移性定植

附图4 在肺MCs中敲除Atgl基因促进肺转移
5. 含脂肺MCs运输脂质以支持肿瘤生长和存活
有研究发现,在大鼠妊娠晚期,胎儿肺成纤维细胞会释放储存的TG以响应肺中PGE2(前列腺素E2)水平的升高。释放的TG被调动到肺上皮细胞,可作为合成表面脂蛋白的底物。在AT3模型中,肺内PGE2水平在转移期(第15天后)明显升高(图S5A),并且PGE2可以有效诱导IL-1β预处理后的肺MCs释放TG(图S5B)。因此,作者推测在转移前期肺MCs中积累的中性脂质可以释放到肺环境中调节转移性肿瘤细胞。并且作者在肺切片中还检测到肺MCs与早期定植肿瘤细胞之间存在密切的相互作用(即在空间上相互靠近)(图5A)。为了更准确地研究中性脂质从含脂MCs向肿瘤细胞的转运及其对肿瘤细胞行为的影响,作者利用AtglΔMCs小鼠的肺MCs代表含脂MCs,这样就可以避免使用肿瘤小鼠肺部MCs时非脂质物质的任何混杂影响。
结果发现,AT3肿瘤细胞与AtglΔMCs小鼠肺MCs在体外共同培养后胞内中性脂质水平高于WT细胞(图5B),并且从含脂的肺MCs到肿瘤细胞的脂质运输过程与细胞-细胞接触无关(图S5C和S5D)。在体内,与WT小鼠相比,AtglΔMCs小鼠肺环境中植入的AT3细胞获得了更高水平的中性脂质(图5C)。在从含脂的MCs中获得中性脂质后,肿瘤细胞内与FAO途径相关的一系列基因表达增加(图S5E),氧化磷酸化水平升高(图5D和S5F);与此同时肿瘤细胞的代谢转向脂质利用方向。
接下来,作者进一步研究确定脂质代谢重编程对肿瘤细胞的影响。与肿瘤细胞内促进脂质利用过程一致,当肿瘤细胞与富含脂(AtglΔMCs) MCs预培养后,可以在体外获得更高的增殖率(图5E),在体内更快地转移生长(图5F)。因此,与WT小鼠相比,肿瘤细胞植入AtglΔMCs小鼠后增殖水平更高;植入HilpdaΔMCs小鼠后增殖水平降低(图S5G)。此外,将肿瘤细胞在富含脂(AtglΔMCs) MCs条件培养基(CM)中预孵育,发现其对实体癌治疗中常用的化疗药物的抵抗力增强(图5G)。在体内,阿霉素对WT小鼠肺转移的治疗作用被宿主Atgl cKO完全抑制(图5H)。因此,乳腺肿瘤细胞摄取含脂MCs来源的脂质后发生代谢重编程,从而增强增殖能力和抗化疗能力。
为了确定活跃的脂质代谢过程是否也发生在人类身上,作者对已有的数据集(GEO: GSE110590)进行了分析,其中包括来自同一乳腺癌患者的肺转移和相应的原发肿瘤的转录谱。与配对乳腺肿瘤相比,肺转移瘤中脂代谢、脂利用以及炎症相关的代谢途径相关基因富集(图S5H)。作者又进一步将肺转移与另一个人的乳腺癌数据集(GEO: GSE14018)的其他器官转移进行比较后也得出了类似的结论(图S5I)。因此,活跃的脂质代谢是小鼠和人类乳腺癌肺转移的共同特征。
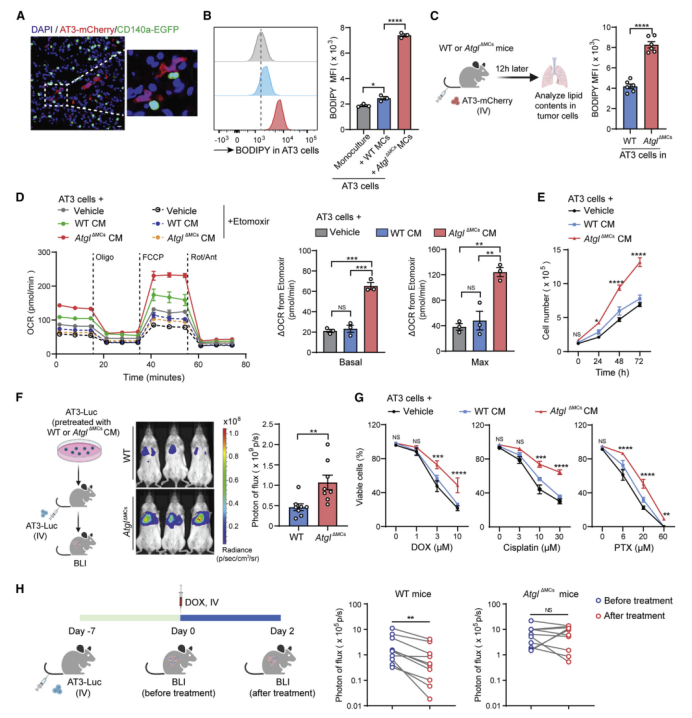
图5 含脂肺MCs运输脂质以支持肿瘤生长和存活

附图5 含脂MCs支持肿瘤生长和存活
6. 含脂MCs代谢重编程NK细胞使其功能障碍
除了上述MC-肿瘤细胞会进行细胞间交流以外,作者猜想富含脂MCs是否可以代谢重塑肺免疫微环境呢?于是作者又对NK(自然杀伤)细胞(肺定殖期间主要抑制癌细胞转移的免疫细胞)进行研究。作者再次利用AtglΔMCs作为富含脂MCs的模型,结果发现:与WT小鼠中的NK细胞相比,尽管AtglΔMCs小鼠肺内NK细胞数量保持不变(图S6A),但NK细胞内中性脂质水平升高(图6A和S6B)。作者首先排除了Atgl KO在NK细胞中泄漏的可能性(图S6C),然后将AtglΔMCs肺MCs与NK细胞进行体外共培养,发现其与WT MCs相比有更高的脂质水平(图S6D)。在体内,植入AtglΔMCs小鼠肺中的NK细胞比植入WT小鼠肺中能获得更多的脂质(图S6E)。加上对肺MC-NK细胞相互作用的原位观察,发现肺MCs-NK细胞彼此在空间上相互靠近(图S6F),上述数据均支持含脂MCs能将储存的中性脂质转运给NK细胞。
与倾向于利用脂质的肿瘤细胞不同(图5D),从AtglΔMCs小鼠分离出的NK细胞比从WT小鼠分离出的NK细胞的氧化磷酸化水平更低,表明其代谢转向脂质存储(图6B)。此外,与WT小鼠相比,AtglΔMCs小鼠肺中NK细胞的基础糖酵解和糖酵解能力也有所降低(图6C)。将NK细胞与AtglΔMCs肺MCs的进行体外共培养也检测到了这些代谢的改变(图S6G和S6H)。尽管以往研究表明,脂质过氧化是抗肿瘤免疫细胞代谢紊乱和功能障碍的原因,但AtglΔMCs和WT小鼠的NK细胞中,脂质过氧化及其相关基因的表达水平相当(图S6I和S6J)。因此,含脂肺MCs对肺内NK细胞的糖酵解和氧化磷酸化产生了不利影响。
NK细胞的糖代谢是合成效应分子和抗肿瘤免疫所必需的代谢过程。此外,以往研究表明肥胖宿主中NK细胞的脂质积累能通过抑制mTORC1(雷帕霉素复合物1)的作用靶点(控制NK细胞激活和功能的基本途径)使其细胞毒性受损。与上述代谢缺陷一致,AtglΔMCs小鼠的肺NK细胞中抗肿瘤的细胞因子和细胞毒性分子的表达下降(图6D和6E),并且抑制了mTORC1的激活,其下游靶点p-S6(S6磷酸化)水平降低(图S6K)。与WT小鼠的NK细胞相比,AtglΔMCs小鼠的肺NK细胞的细胞毒性显著降低(图6F),抑制肺转移定植的能力降低(图6G)。综上所述,含脂MCs代谢重编程肺内NK细胞使其发生功能障碍。
拓展阅读
mTORC1与糖代谢的关系
哺乳动物雷帕霉素靶蛋白(mTOR)是细胞生长和增殖的重要调节因子,具有从酵母到人的保守结构和功能。它是一种非典型的蛋白激酶,与脂质激酶具有同源性,但可磷酸化蛋白质。mTOR的激活及其底物的后续磷酸化主要发生在膜室中。
研究表明,mTOR在营养转运蛋白的转运和表达调控中起着重要作用。此外,mTOR是营养信号级联的一个组成部分,mTOR通路受ATP水平的影响。对不同模式生物的研究表明,TOR/mTOR控制细胞生长或细胞质量的增加,这与控制细胞增殖或分裂是不同的。利用雷帕霉素和全基因组筛选进一步研究表明,TOR蛋白介导营养代谢相关基因的表达。在酵母中发现TOR同时具有雷帕霉素敏感和不敏感功能,这表明TOR形成了不同的蛋白质复合物,即雷帕霉素敏感的mTORC1和雷帕霉素不敏感的mTORC2。文章中提到的是mTORC1。
mTORC1通过诱导和调控两个关键转录因子HIF1α和Myc促进糖酵解。mTORC1能增加HIF1α的转录和翻译。在缺氧条件下,HIF1α蛋白水平保持稳定并有一定积累,这增强了编码糖酵解酶和效应物的基因的转录表达,从而促进糖酵解的发生。在机体内,mTORC1激活水平被严格调控以维持葡萄糖稳态。对于一些以mTORC1过度激活为特征的疾病,可以通过雷帕霉素或其类似物来治疗,帮助病人恢复正常的糖代谢过程。
参考文献:
[1] Szwed, Angelia et al. Physiological reviews vol. 2021.
7. 含脂MCs通过外泌体将脂质运输到肿瘤细胞和NK细胞
富含脂质的细胞主要通过两种形式将脂质转移到周围细胞,分别是游离脂肪酸和大尺寸的胞外囊泡。在体外实验中,作者确定了来自含脂MCs条件培养基(CM)的大尺寸(>100 kDa)胞外囊泡是肿瘤细胞和NK细胞的主要脂质提供者(图6H-6J)。电镜下,作者检测到大尺寸胞外囊泡的直径在30 ~ 100 nm(图S6L),大小与外泌体相似;而且还鉴定出典型的外泌体标记物—CD9、CD63和CD81(图6K)的表达,并且从富含脂(AtglΔMCs)的肺MCs分离的外泌体中TG的水平高于WT MCs(图S6M)。此外,肿瘤细胞和NK细胞在体外和体内都能吸收含脂MC衍生的外泌体(图6L和S6N)。因此,含脂MCs主要通过外泌体样囊泡向肿瘤细胞和NK细胞转运脂质。
受体细胞可通过各种内吞途径摄取胞外囊泡。作者在使用不同类型的内吞作用的选择性抑制剂进行筛选后,最终确定肿瘤细胞和NK细胞主要通过巨胞饮摄取来自含脂MCs的脂质(图6M和6N)(小编注:巨胞饮(macropinocytosis)是细胞非选择性内吞胞外液体的过程。巨胞饮与其它内吞形式存在相似之处,形成的囊泡结构都经历向细胞中心移动、酸化、最终与溶酶体融合等步骤)。脂质被内吞后进入肿瘤细胞的溶酶体内(图S6O),这表明肿瘤细胞可能通过溶酶体途径利用脂质以满足其生长和营养物质的需求。在体内,用LY294002阻断AtglΔMCs小鼠的巨胞饮能有效减少植入肿瘤细胞和常驻NK细胞中的脂质积聚(图S6P),并相应地降低植入肿瘤细胞的增殖水平(图S6Q),促进NK细胞效应分子的表达(图S6R);此外,LY294002可有效抑制AtglΔMCs小鼠的肿瘤细胞定植(图6O)。因此,抑制含脂MCs的脂质转运可以阻止肿瘤细胞和NK细胞的代谢重编程,进而减少转移性定植。
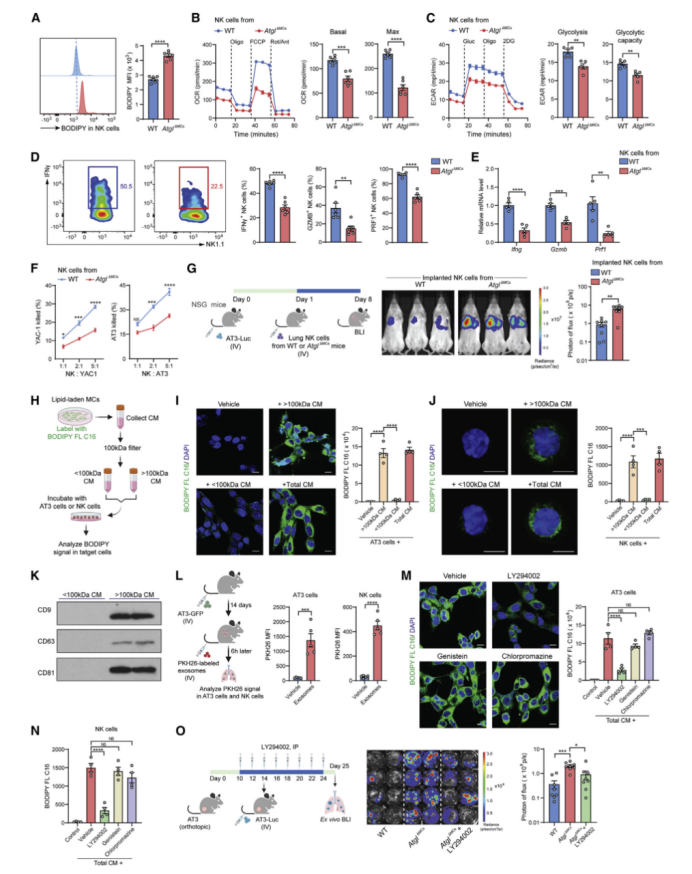
图6 含脂MCs代谢重编程NK细胞使其功能障碍
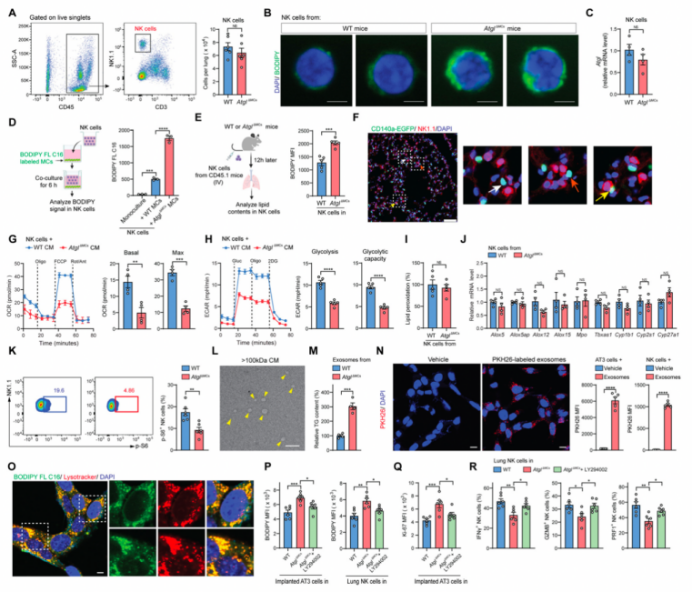
附图6 含脂MCs将脂质运送到NK细胞使其功能障碍
拓展阅读
癌细胞与溶酶体的关系
溶酶体是一种膜包裹的囊泡细胞器,含有两类维持结构和功能所必需的蛋白质:可溶性溶酶体水解酶和溶酶体膜蛋白,前者执行消化功能,后者具有更复杂的功能,如起质子泵和促进细胞间相互作用。溶酶体内含有神经鞘磷脂酶和酸性脂肪酶(LAL)等多种水解脂类的酶,可进行脂质的分解代谢。如LAL主要降解脂蛋白和自噬体中的CEs(胆固醇酯)、TGs(甘油三酯),释放FC(胆固醇)和FA(脂肪酸),其中游离FC作为脂滴转移到细胞质中形成脂肪堆积的泡细胞;或转移到细胞膜上形成脂筏。此外,CEs和TGs水解释放的FA用于膜组装和能量生产,最近研究发现FA在脂质介质以及肝细胞极低密度脂蛋白(VLDL)的组装合成中还发挥着重要作用。
癌细胞以加快的速度分裂和增殖,为此它们需要脂质来装配细胞膜。研究表明,脂质还能够发送信号,促进癌症的发生发展。癌细胞通过调节溶酶体的数量、组成和活性来上调其新陈代谢,以满足细胞生长和增殖的需要。此外,溶酶体的移位和异常分泌有利于癌细胞的侵袭和转移。
参考文献:
[1] Ballabio, et al.Nature reviews.Molecular cell biology. 2020.
[2] Piao, et al. Annals of the New York Academy of Sciences. 2016.
[3] Zhang H. Lysosomal acid lipase and lipid metabolism: new mechanisms, new questions, and new therapies. Curr Opin Lipidol. 2018.
8. IL-1β阻断可减轻肺转移,提高NK细胞免疫治疗的疗效
作者受干扰脂质转运能减少肺转移的启发,猜想是否能通过中和IL-1β阻止含脂MC的形成(图2H)来削弱转移定植,这或许是重塑肺代谢微环境的另一种可行手段。在AT3模型中,IL-1β抗体重新激活肺内NK细胞,使其脂质储存减少(图7A),效应分子表达增加(图7B, S7A和S7B),肿瘤杀伤活性升高(图S7C)。此外,IL-1β抗体在不同的小鼠乳腺肿瘤模型中均显示出有效的抑制转移的作用(图7C、S7D和S7E)。因此,靶向IL-1β这一诱导含脂MC形成的上游“开关”,是缓解乳腺癌肺转移的有效措施。
作者进一步研究揭示了IL-1β诱导的含脂MCs促进肺转移的两个下游机制:NK细胞和肿瘤细胞的代谢调节。为了区分这两种转移机制,作者在宿主NK细胞衰竭的AT3模型中进行抗IL-1β治疗。随着NK细胞的衰竭(图S7F), IL-1β抗体的抑制定植作用有所下降,但并未完全消除(图S7G),这表明这两种机制都存在促进转移的调节作用。此外,考虑到IL-1β在肿瘤和组织微环境中的多重作用,作者想要进一步确定IL-1β抗体的作用是否部分是含脂MC独立作用产生的。结果发现,尽管靶向敲除MC的Hilpda和Atgl降低了IL-1β抗体的有效性,但它仍显著抑制了cKO小鼠的转移定植(图S7H和S7I)。因此,IL-1β分别通过含脂MC依赖的和非依赖作用调节乳腺癌的肺转移。
基于NK细胞的癌症治疗方法在过去的十年中取得了巨大的进步,这主要得益于NK细胞的固有免疫特性,不受特定肿瘤抗原的限制。由于阻断IL-1β能够重新激活内源性NK细胞的功能,作者又提出阻断IL-1β是否也能增强在转移治疗中NK细胞的过继转移治疗疗效。为了排除内源性NK细胞的影响,作者使用内源性NK细胞免疫缺陷的NOD-scid IL2rγnull(NSG)小鼠作为宿主。虽然抗IL-1β治疗和NK细胞过继转移的单一疗法都表现出显著但温和的治疗益处,但它们的联合使用表现出协同且强大的疗效。与对照组相比,转移负担约减少了7倍(图7D)。与小鼠相似,在人细胞中也发现了IL-1β-含脂的肺MC-NK细胞功能障碍的代谢轴(图S7J和S7K),并且体内IL-1β抗体可有效提高人NK-92细胞治疗人乳腺癌细胞肺转移的疗效(图7E)。因此,针对IL-1β的联合免疫疗法在治疗转移性疾病方面具有良好的发展前景。
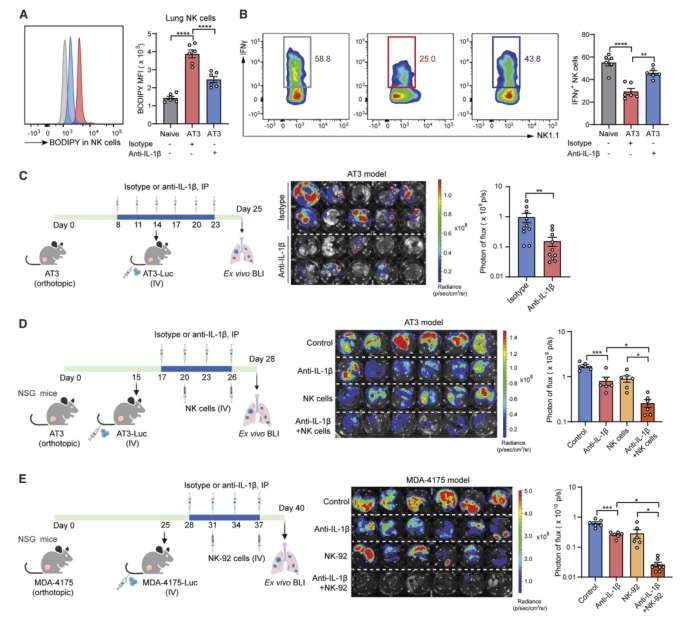
图7 IL-1β阻断可减轻肺转移,提高NK细胞免疫治疗的疗效
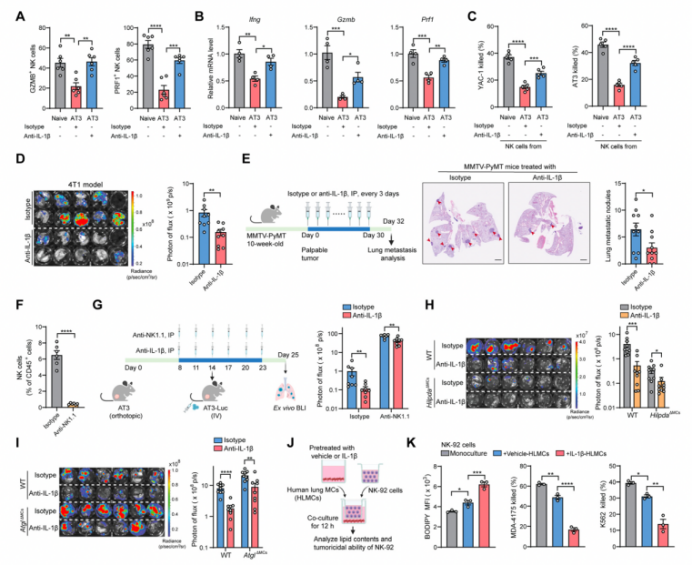
附图7 靶向IL-1β可恢复NK细胞的抗肿瘤免疫功能
拓展阅读
过继性细胞免疫治疗
过继性细胞免疫是将供体的淋巴细胞转移给受体,增强其细胞免疫功能,是肿瘤生物治疗的主要内容。过继性细胞免疫可分为特异性和非特异性两类,前者是用已知抗原致敏的淋巴细胞注入受体后使其获得对该抗原的细胞免疫能力;后者是用未经特殊抗原致敏的正常人淋巴细胞注入受体后使其获得对多种抗原的细胞免疫能力。
可用于过继免疫治疗的抗肿瘤效应细胞主要包括LAK细胞(淋巴因子激活的杀伤细胞)、TIL(肿瘤浸润淋巴细胞)、CD3AK(抗CD3单抗激活的杀伤细胞)、PAK(PHA激活的杀伤细胞)、CTL(细胞毒性T细胞)、NK细胞(自然杀伤细胞)等,其中LAK,TIL等已进入临床应用阶段,CTL,NK细胞作为最有前途的抗癌效应细胞,正在进行临床前期研究。
肿瘤过继免疫治疗的最佳效应细胞是以CTL为代表的特异性杀伤细胞,CTL杀伤靶细胞时的MHC(主要组织相容性复合体)限制性,既给CTL过继治疗带来巨大阻碍,也是CTL特异性杀伤的分子基础。近几年来对肿瘤特异性抗原的认识,以及对MHC-TCR-抗原肽三元体结构研究的突破性进展,为CTL特异性主动免疫和过继免疫治疗奠定了基础。
而文中提到的NK细胞的过继转移治疗属于非特异性疗法,该疗法没有明确的免疫细胞靶点,是从整体上提高人体免疫力而达到缓解肿瘤症状。
参考文献:
[1] Laskowski, Tamara J et al. Nature reviews. Cancer. 2022.
总结
在本研究中,作者发现了在肿瘤转移过程中远端器官微环境对原发肿瘤的代谢调节作用。前期研究发现:在乳腺癌模型中,MCs在转移前阶段积累中性脂质。而肺转移前微环境的形成需由原发肿瘤或宿主源性因子触发,于是作者对先前报道的转移前微环境调节因子进行体外筛选,最终发现IL-1β是刺激肺MCs中性脂质积聚的最有效的一类调节因子。
进一步研究发现,IL-1β主要通过HIF1A~HILPDA~ATGL的级联作用抑制TG脂解,从而诱导肺MCs中脂质积聚。此外,小鼠中MCs特异性地敲除ATGL或HILPDA基因后能分别增强和减少乳腺癌的肺转移,这表明含脂MCs具有促进转移的作用。在机制上,含脂的MCs通过外泌体样囊泡将其脂质运输到肿瘤细胞和NK细胞(自然杀伤细胞),使其代谢重编程,进而促进肿瘤细胞增殖以及NK细胞功能障碍。作者受干扰脂质转运能减少肺转移的启发,进一步研究阻断IL-1β的作用效果,结果发现:IL-1β阻断可减轻肺转移,提高NK细胞免疫治疗的疗效。总之,含脂的肺MCs代谢调节肿瘤细胞和抗肿瘤免疫,促进乳腺癌肺转移。
原文链接: https://doi.org/10.1016/j.cmet.2022.11.003
关注微信公众号代谢学人
了解更多代谢前沿资讯

https://m.sciencenet.cn/blog-3483272-1401352.html
上一篇:代谢学人--Cell Metabolism:看线粒体如何“嵴”速享“瘦”
下一篇:代谢学人--Cell Metabolism:Sucnr1--守护脂肪细胞,维持代谢稳态