博文
代谢学人--Nature Metabolism:胰岛素敏感性:谁动了我的BCAA?
||
代谢学人
Nature Metabolism:胰岛素敏感性:谁动了我的BCAA?
撰文 | 徐梓禾 于柳 武霞 郭钰涵 邱瑾
编辑 | 孟美瑶
校对 | 于柳

背景介绍
国际糖尿病联盟(IDF)发布的数据显示,全球糖尿病发病率已达到9.3%。其中90%的人患有2型糖尿病(T2D),表现为胰岛素抵抗(IR),其胰岛素需求大于胰腺产生胰岛素的能力,会引起高血糖和许多并发症,包括视力损失,肾脏疾病和心脏疾病。而胰岛素抵抗的发展机制尚不清楚。
支链氨基酸(BCAAs)(缬氨酸,亮氨酸,异亮氨酸)是必需氨基酸,必须从膳食蛋白中获取。BCAAs可用于合成新的蛋白质,或通过SLC25A44运入线粒体进行分解。在分解过程中,BCAAs先通过支链氨基转移酶(BCAT1和BCAT2)的转氨作用形成支链α-酮酸(BCKAs)(包括α-酮异戊酸(α-KIC),α-酮β-甲基缬氨酸(α-KMV)和α-酮异戊酸(α-KIV)),然后通过支链α-酮酸脱羧酶(BCKDH)的脱羧和脱氢这一限速步骤进行降解,最终缬氨酸降解为琥珀酰CoA,亮氨酸降解为乙酰乙酸和乙酰CoA,异亮氨酸降解为丙酰CoA和乙酰CoA;分别参与成糖和成酮反应,进入三羧酸循环。而支链酮酸脱氢酶激酶(BCKDK)能够磷酸化BCKDH从而抑制其功能,蛋白磷酸酶PP2Cm(由基因PPM1K编码)的去磷酸化则能激活BCKDH。
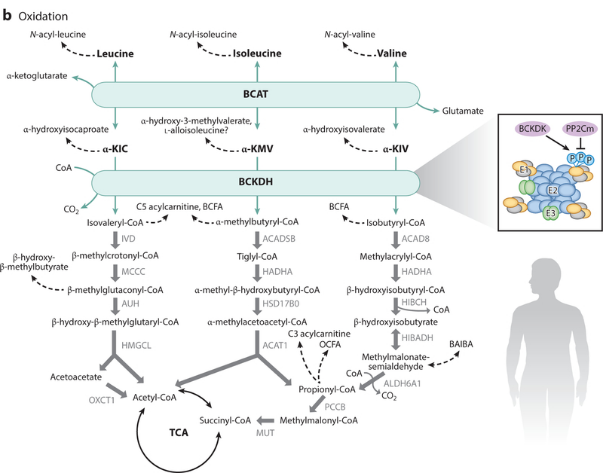
BCAA的分解代谢示意图
早在20世纪60年代,人们就推测血浆高浓度的BCAA与IR和T2D有关。而最近的研究证实了血浆BCAAs升高和T2D的发展相关, 并且BCAA分解代谢与IR相关。一项遗传孟德尔随机化研究将T2D 与PPM1K基因表达相关联,支持了BCAAs和T2D的因果关系。此外,多个研究团队通过高胰岛素-正葡萄糖钳夹试验(HIEC),发现氨基酸输注或摄入可诱发IR,并且将BCAAs添加到高脂饮食(HFD)中会严重恶化IR。相反,抑制BCAA的摄入会使啮齿动物对胰岛素敏感。而且用小分子3,6-二氯苯并(b)噻吩-2-羧酸(BT2)系统性抑制BCKDK可改善IR和T2D啮齿动物模型的胰岛素敏感性。一项人体研究也表明,使用BT2的类似物——苯丁酸钠来治疗T2D,可以抑制BCKDK,降低血浆BCAAs浓度并增强胰岛素敏感性。尽管进行了这些研究,但BCAAs及其分解代谢对IR的作用机制仍不清楚。
在本文中,作者利用IR和T2D小鼠模型,探讨了BCAAs对IR作用机制的相关问题:“胰岛素敏感性是通过降低血浆BCAA还是通过调节特定组织中的BCAAs分解代谢而改善的?”作者研究发现,骨骼肌(SM)或肝脏中的BCAA氧化,不论单独或联合,对雄性小鼠的胰岛素敏感性没有影响;降低空腹血浆BCAA不足以改善胰岛素敏感性。

敲黑板啦!
1、系统性BCAA氧化会增强胰岛素敏感性
2、增加或减少骨骼肌(SM)中BCAA氧化不影响正常喂养小鼠/HFD小鼠的胰岛素敏感性
3、增加肝脏BCAA氧化不影响HFD小鼠的胰岛素敏感性
4、减少肝脏BCAA氧化不影响正常喂养小鼠/HFD小鼠的胰岛素敏感性
5、在SM和肝脏中双敲除BCKDK不影响胰岛素敏感性
研究结果
1. 、系统性BCAA氧化增强胰岛素敏感性
已有研究结果表明,BT2系统性激活BCAA氧化可保护机体免受葡萄糖不耐受的影响。作者尝试验证这些发现并探究BT2如何快速增强胰岛素敏感性。与对照组相比,急性BT2处理可抑制小鼠多种组织中的BCKDH磷酸化(pBCKDH)(图1a和附图1a-c)。在饥饿(Fast)和再进食(Refer)状态下素水平与脂肪储存成正比,并在进食后增加。1994年瘦素的发现使我们对脂肪组织概念发生转变(小编注:BCAA会促进胰岛素释放,而在饥饿与再进食状态下,胰岛素含量会有显著变化,因此,为了研究BCAA分解代谢对胰岛素敏感性的作用,选择了这两种状态进行研究),血浆BCAA浓度在BT2急性或慢性处理的小鼠中明显较低,而在对照组小鼠中则相对较高(图1b和附图1d)。此外,循环BCKA也在BT2处理的小鼠中明显较低(小编注:血浆中的BCAA需要转运进细胞内发挥作用。血浆中的BCAA由L型氨基酸转运体(LAT)运进细胞,例如,棕色脂肪组织通过SLC25A44介导BCAA向线粒体转运,从而清除血液BCAA并利用它们产生能量和热量。BCAAs通过支链氨基转移酶(BCAT1和BCAT2)的转氨作用形成支链α-酮酸(BCKAs)的反应是可逆的, BCKA可以重新被加上氨基生成BCAA,胞内BCKA也可以被单羧酸转运体1分泌到细胞外,由此来维持细胞中BCAA和BCKA的平衡),对照组小鼠则相对较高(图1c)。然后,作者以高脂饮食喂养小鼠5周,并给予BT2(急性或慢性)或对照处理。结果发现在葡萄糖耐量试验(GTT)中,两种治疗都显著改善了葡萄糖清除率,在慢性BT2治疗后,曲线下面积(AUC)降低了约20%,胰岛素反应也显著降低(图1d-i)。各组间没有体重差异(附图1e-g)。因此作者得出结论,BT2部分逆转了由高脂饮食引起的胰岛素抵抗,并且BT2的作用是快速的。
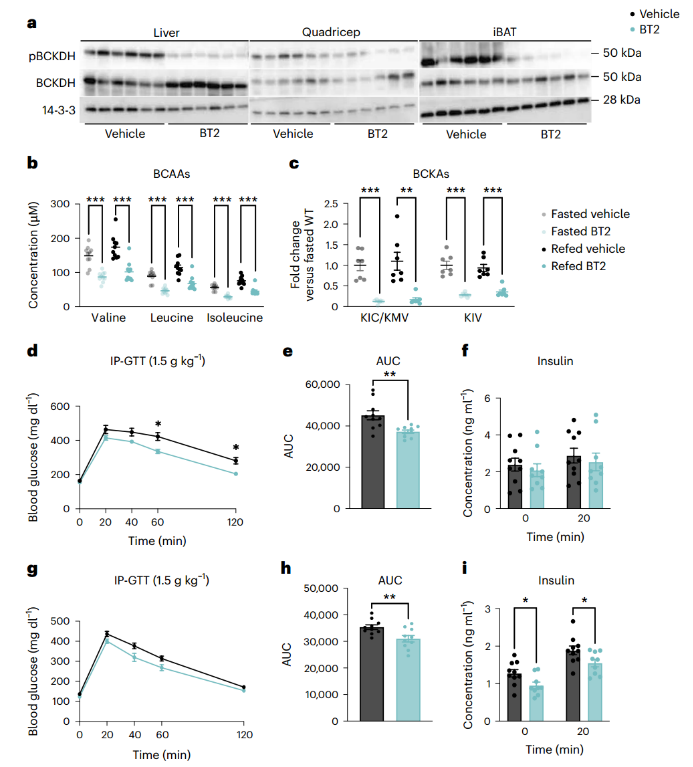
图1. 系统性BCAA氧化增强胰岛素敏感性
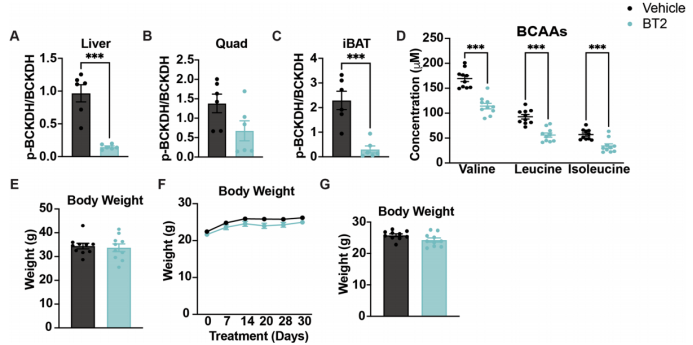
附图1. 急性或慢性的BT2治疗不影响体重
2. 增加SM中BCAA的氧化不影响正常喂养小鼠的胰岛素敏感性
SM是葡萄糖利用的主要部位,且约占全身BCAA氧化的60%。作者和其他研究人员推测,增加SM中BCAAs的氧化可以促进胰岛素抵抗。为了验证这一想法,作者使用CRISPR-Cas9技术在小鼠Bckdk两端引入loxP位点,并将其与由人骨骼肌肌动蛋白(HSA,也称为ACTA1)启动子驱动Cre表达的小鼠进行杂交,从而获得他莫昔芬诱导的Bckdk SM条件性敲除小鼠(BckdkloxP/loxP-HSA-CreER)。股四头肌的mRNA表达(附图2a-d)和蛋白质印迹证实,在他莫昔芬处理后,饥饿组BckdkloxP/loxP-HSA-CreER小鼠特异性敲除Bckdk后,股四头肌和膈肌中Bckdk表达显著降低,小鼠表现正常,体重无明显变化(图2a和附图2e-j)。与BCKDK的作用一致,饥饿组BckdkloxP/loxP-HSA-CreER小鼠的SM中BCKDH的磷酸化(pBCKDH)水平相比对照组显著降低,并对BCKDH mRNA表达或总蛋白量没有影响(图2a和附图2c,d,k-o)。先前研究发现,在大鼠肝脏中过表达BCKDK可以增加ATP-柠檬酸裂解酶(ACLY)的磷酸化,ACLY能将支链氨基酸分解和脂肪从头合成联系起来。(小编注:ACLY是一种ATP依赖性的胞质酶,在ATP的作用下,ACLY可以催化柠檬酸和辅酶A转化为乙酰辅酶A和草酰乙酸酯。ACLY是产生胞浆乙酰辅酶A的主要作用酶,而乙酰辅酶A对脂肪酸代谢、胆固醇的生物合成等生化过程至关重要,是胆固醇和脂肪酸从头合成所需的前体,因此ACLY能将支链氨基酸分解和脂肪从头合成联系起来。)然而,在饥饿组BckdkloxP/loxP-HSA-CreER小鼠中,肝脏的pACLY或ACLY不受影响(附图2p,q)。SM的苏木精-伊红染色(H&E)也显示正常(图2b和附图2r)。此外,BckdkloxP/loxP-HSA-CreER小鼠血浆中的BCAA和BCKA明显低于对照组,证实了SM对全身支链氨基酸氧化的作用。令人惊讶的是,再进食组小鼠的血浆中BCAA和BCKA在不同基因型小鼠之间没有差异(图2c、d)。与对照组相比,BckdkloxP/loxP-HSA-CreER小鼠在饥饿和再进食状态下的循环3-羟基异丁酸(3-HIB)和缬氨酸比值显著增加(附图2s),而3-HIB浓度仅在再进食状态下显著升高,这与升高的代谢通量一致(附图2t)。为了测试Bckdk在骨骼肌中的敲除对胰岛素敏感性的影响,作者对BckdkloxP/loxP-HSA-CreER和对照小鼠进行了葡萄糖耐量实验,同时采集血液以测量胰岛素浓度。结果表明两组小鼠对葡萄糖的反应没有差异(图2e,f)。胰岛素浓度在基线和葡萄糖刺激后的20分钟内没有变化(图2g)。尽管禁食时循环BCAAs浓度显著降低,表明SM中的BCAA代谢通量增加,但与正常饮食的对照组相比,Bckdkloxp /loxP-HSA-CreER小鼠的胰岛素敏感性没有变化。
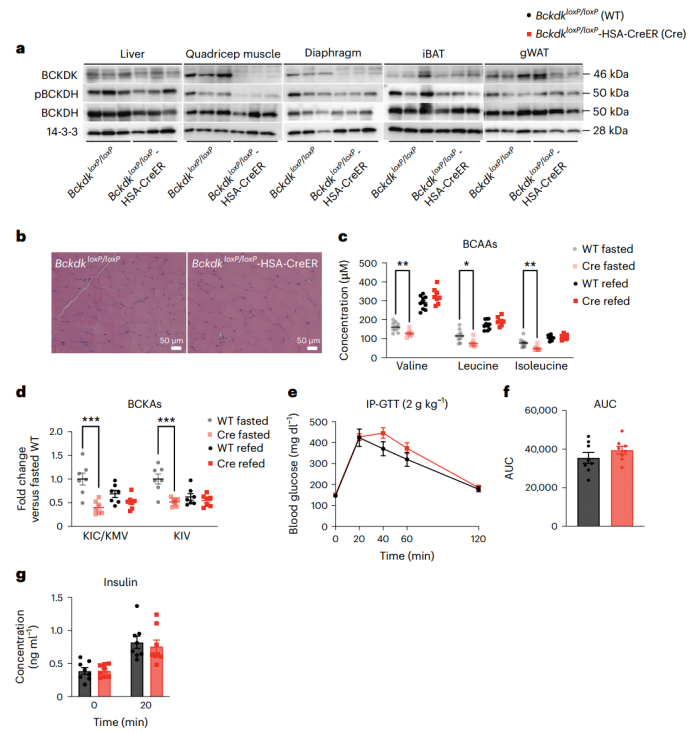
图2. SM中BCAA氧化增加不影响正常喂养小鼠的胰岛素敏感性
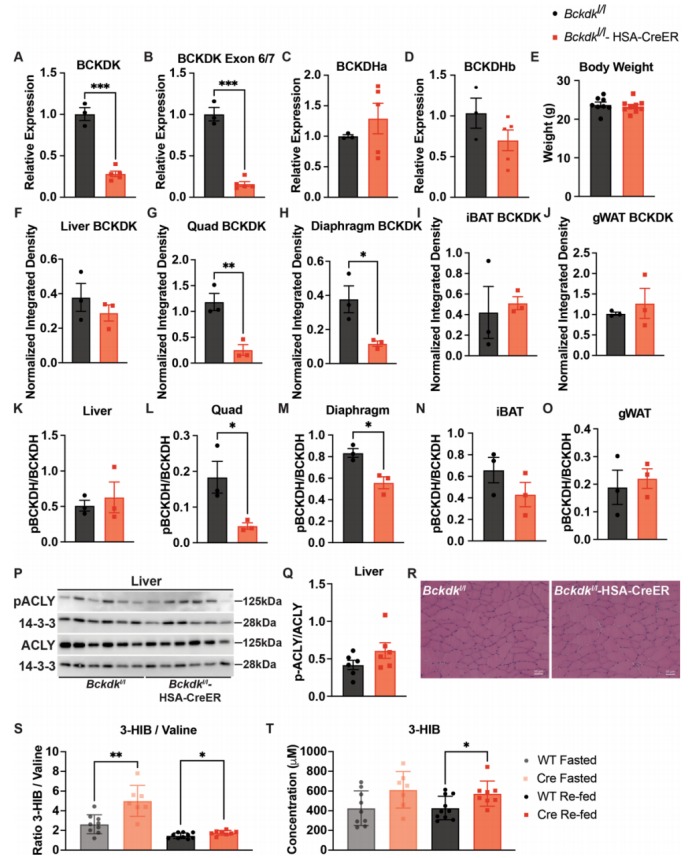
附图2. BCKDK SM特异性敲除不影响体重或肌肉生理
拓展阅读
3-羟基异丁酸(3-HIB)与代谢和免疫系统
3-羟基异丁酸(3-HIB)是一种代表性的支链氨基酸(BCAAs)代谢产物。BCAAs是人体必需氨基酸的一种,它们在蛋白质代谢中起着重要作用。在健康的人体内,BCAAs被肌肉等组织摄取并被氧化为能量。然而,在某些疾病状态下,如糖尿病、肥胖等,BCAAs代谢会发生紊乱,导致BCAAs水平升高,并伴随着肥胖和胰岛素抵抗等症状。
3-HIB作为BCAAs代谢产物,被广泛用于研究BCAAs代谢紊乱与相关代谢性疾病之间的关系。在这篇文章中,作者使用3-HIB作为BCAAs代谢的指标之一,来评估改变BCAAs代谢对胰岛素敏感性的影响。
另外,3-HIB也被证明可以通过与GPR109A结合,对代谢和免疫系统产生重要作用。GPR109A是一种G蛋白偶联受体,广泛分布于多个组织和细胞类型中,特别是脂肪细胞和免疫细胞。3-HIB与GPR109A结合后,可以抑制脂肪细胞的分化和脂肪酸的合成,并促进脂肪酸的氧化和糖原的合成。此外,3-HIB还可以促进免疫系统的抗炎作用和代谢适应性。
总之,3-HIB影响着代谢和免疫系统,是一种具有重要生物学功能的分子。
3. 增加SM中BCAA的氧化不影响HFD喂养小鼠的胰岛素敏感性
添加BCAAs的HFD与对照HFD相比会恶化小鼠的IR,但添加BCAAs的普通饲料与对照饲料相比,对小鼠IR没有影响。因此,作者使用了评估胰岛素敏感性的标准方法,将BckdkloxP / loxP-HSA-CreER小鼠置于西方饮食中(小编注:西方饮食模型饲料是一个大的概念,只要是高脂、高糖、高胆固醇等其中某2项或3项都称为西方饮食模型饲料。广泛应用于大小鼠肥胖模型、高血脂模型、高胆固醇血症模型、胰岛素抵抗模型、II型糖尿病模型等),并进行了HIEC(高胰岛素-正葡萄糖钳夹)实验。作者同时利用[U-13C]标记的BCAAs的非干扰性输注,来评估胰岛素对BCAA转化和组织特异性氧化的影响。随后使用液相色谱-质谱(LC-MS)区分重型[U-13C]标记代谢物与未标记代谢物,得到[U-13C] 标记的BCAA输注速率,计算出内源性BCAA出现率(Ra),即来自蛋白质分解的BCAAs量(小鼠处于禁食状态,因此没有来自蛋白质摄入的BCAA)。分析带有13C的三羧酸循环(TCA)中间产物,并将其与血浆标记的BCAA进行归一化,揭示了BCAA中的碳对TCA循环的中间产物的相对贡献,也反映了每种组织中的BCAA氧化。
各基因型在体重、饱食状态下的血浆BCAA或3-HIB水平均没有差异(附图3a-d)。西方饮食条件下,BckdkloxP/loxP-HSA-CreER小鼠在HIEC之前(basal)和期间(clamp)的空腹血浆BCAAs和BCKAs水平均显著降低(图3a,b)。其它氨基酸的血浆水平没有差异(附图 3e)。钳夹期间的胰岛素水平升高使得两种基因型小鼠的血浆BCAA和BCKA水平都降低(小编注:根据以往研究来看,可能是胰岛素水平升高促进了全身BCAA的氧化分解,使BCAA在血液中的积聚减少,从而使其血浆BCAA水平都降低;而BCKA是BCAA通过BCKDK分解的产物,如果BCAA下降是由BCKDK介导的 ,那么其产物BCKA的水平应该升高,而现在BCKA水平也在降低,说明BCAA降低的结果并非由BCKDK介导)(图3a,b),这表明胰岛素的这种作用不是通过肌肉BCKDK介导的。在HIEC之前和期间稳定输注U-13C-BCAAs,对BCAAs进行稳态血浆标记(附图3f)。尽管在钳夹期间,胰岛素抑制了各组的BCAAs的出现率(Ra),但是在钳夹之前和钳夹期间,BckdkloxP/loxP-HSA-CreER和对照组小鼠的血浆BCAA Ra没有统计学差异(小编注:说明胰岛素确实会降低BCAA水平,但这一过程的发生不是由基因型差异导致的)(图3c)。在饥饿状态下,与对照组相比,BckdkloxP/loxP-HSA-CreER小鼠的股四头肌组织中,标记BCAA衍生的TCA循环中间体增加了大约2倍,这表明BCAA的氧化水平明显增加(图3d)。在肝脏、肩胛骨间棕色脂肪组织(iBAT)和腹腔白色脂肪组织(gWAT)中,BCAA的相对氧化水平略有差异,都只部分减少了标记BCAA衍生的TCA循环中间体的相对含量,这表明SM、肝脏和脂肪组织在调节BCAA氧化方面存在某种相互作用(小编注:从图上看特异性敲除小鼠骨骼肌中的Bckdk,可显著增加骨骼肌中BCAA衍生的三种TCA循环中间体——琥珀酸、苹果酸和谷氨酸的相对含量,和之前报道一致,即骨骼肌中主要进行BCAA氧化。而其他些组织,如肝脏、iBAT和gWAT,可作为BCAA分解产物的重要代谢器官。但结果显示每种组织只有一种TCA循环中间体显著下降,说明SM、肝脏和脂肪组织在调节BCAA氧化方面可能存在相互作用)(附图3g-i)。作者通过BCKDH活性测定,确认了在饥饿组BckdkloxP/loxP-HSA-CreER小鼠的股四头肌中,BCKDH活性显著增加(附图3j)。总之,这些数据证实了BckdkloxP/loxP-HSA-CreER小鼠的SM中BCAA氧化增加,这与BCKDK的已知作用一致。
作者接下来使用HIEC检测西方饮食小鼠的胰岛素敏感性。在HIEC测量中,在钳夹50分钟内小鼠即达到了稳定的血糖水平(图3e)。然而,葡萄糖输注速率(GIR)或稳态GIR没有差异(稳态GIR定义为HIEC的最后30分钟,平均血糖保持在100 mg/dl和150 mg/dl之间),并且BckdkloxP/loxP-HSA-CreER小鼠和对照组之间的GIR没有变化(图3f,g),表明胰岛素敏感性没有差异。在钳夹之前和钳夹期间测量的胰岛素浓度证实,所有小鼠都表现为高胰岛素血症,并且组间没有差异(图3h)。在钳夹之前和钳夹期间输注D-葡萄糖-6,6-d2后发现,葡萄糖的内源性Ra在两组之间无差异,表明组间胰岛素介导的抑制肝糖异生的作用相似(图3i)。D-葡萄糖-6,6-d2中的氘原子在进入TCA循环之前被去除,因此不会干扰U-13C-BCAA的碳标记。在进行HIEC之前,作者还对这些西方饮食小鼠进行了GTT实验,结果显示各组间没有显著差异(附图3k,l)。
然后,作者进一步探究HFD小鼠中的作用,并在HFD饮食4和10周后进行GTT。与喂养普通饲料和西方饮食的小鼠一样,HFD喂养的BckdkloxP / loxP-HSA-CreER小鼠在禁食下的血浆BCAAs和BCKAs明显减少;然而,在此饮食下,小鼠在再进食状态下的BCKAs也减少(图3j,k)。在饥饿状态下,HFD喂养的BckdkloxP / loxP-HSA-CreER小鼠的3-HIB和缬氨酸比值也明显增加,但再进食组却没有增加(附图4a,b)。在HFD喂养下4和10周后,尽管BckdkloxP/loxP-HSA-CreER小鼠在10周时会发生显著的胰岛素抵抗(附图4c–e),但是与对照组相比,其葡萄糖耐受性(图3l,m和附图4c,d)或胰岛素水平(图3n和附图4e)没有任何差异。在HFD 喂养4周时,两组小鼠的体重和瘦质量没有差异(附图4f,g)。在HFD喂养10周后,小鼠体重进一步增加,但两组间的体重仍然没有差异(附图4h)。总之,在各饮食下,SM中BCAA的氧化水平增加对于禁食小鼠的胰岛素敏感性均没有明显影响。
与自由进食小鼠或者饥饿后在多种饮食条件下喂养的小鼠相比,BckdkloxP/loxP-HSA-CreER小鼠的循环血浆支链氨基酸没有明显变化(图2c和3j以及附图3b)。蛋白质印迹结果证实,与对照组相比,再进食组BckdkloxP/loxP-HSA-CreER小鼠的股四头肌样本中BCKDK缺失(图3o和附图4i-k)。同样,与对照组相比,再进食组BckdkloxP/loxP-HSA-CreER小鼠的股四头肌中BCKDH的磷酸化水平较低(图3o和附图4l-n)。而pACLY和ACLY没有受到影响(附图4o,p)。为了检测在饱食状态下BckdkloxP/loxP-HSA-CreER小鼠SM中BCAA氧化是否增加,作者在再进食2小时后给予[U-13C]标记的BCAA,并在10分钟后收集组织。各组间血浆BCAAs标记相同(附图4q)。而TCA循环中间体的13C富集分析表明,相比对照组,BckdkloxP/loxP-HSA-CreER小鼠股四头肌中BCAA标记碳的比例更高,表明SM中BCAAs氧化增加(图3p)。肝脏、iBAT或gWAT中碳标记的BCAA衍生的TCA循环中间体的相对含量没有差异(附图4r-t)。BCKDH活性检测证实,与对照组相比,再进食组BckdkloxP/loxP-HSA-CreER小鼠的股四头肌活性增加(附图4u)。这些结果表明,在饥饿和再进食状态下,BckdkloxP/loxP-HSA-CreER小鼠中SM特异性的BCAA氧化水平显著增加。
BT2显著降低循环血浆BCAAs并改善胰岛素敏感性(图1),而SM中BCKDK的缺失则不会造成影响,这表明BT2的作用不是通过SM介导的。为了验证这一点,作者以BT2和对照溶液处理BckdkloxP/loxP-HSA-CreER小鼠,发现BT2进一步降低了BckdkloxP/loxP-HSA-CreER小鼠血浆中的BCAAs和BCKAs,表明其作用是由SM以外的组织介导的(图3q和附图4v)。GTT结果显示,与对照组小鼠相比, BT2处理的BckdkloxP/loxP-HSA-CreER小鼠的葡萄糖耐量显著改善(图3r, 5)。而胰岛素浓度和体重没有差异(图3t和附图4w)。这些结果表明,尽管SM是BCAA氧化的主要部位,但存在其他组织通过激活BCAA氧化介导胰岛素敏感性的改善。
为了更好地了解年轻Ad-Sucnr1 KO小鼠尽管脂肪量较低(骨骼肌质量相似)但体重增加的现象,作者评估了脂肪细胞中Sucnr1敲除是否会间接影响骨骼质量。在小鼠的总体重中,其骨骼质量占约5%。胫骨的微型计算机断层扫描分析显示,脂肪细胞Sucnr1的敲除改变了皮质骨质量。Ad-Sucnr1 KO小鼠的皮质骨体积显著大于Sucnr1fl / fl小鼠,同时皮质骨中部周围的皮质厚度和骨周长也显著增加(图3A)。相同小鼠的骨小梁结构未发生变化(图3B),但是Ad-Sucnr1 KO小鼠的胫骨长度明显较长(图3C)。不同基因型单位骨表面的破骨细胞(Ocls)数量相当(图3D)。但胫骨切片的苏木精-伊红(H&E)染色显示,Ad-Sucnr1 KO小鼠皮质骨中单位骨面积的骨细胞(Ocys)数量以及皮质骨和骨小梁表面的成骨细胞(OBs)数量都显著更高(图3E)。与脂肪细胞相似,OBs起源于间充质干细胞(MSCs)。骨髓MSCs的OB分化潜力的分析未显示出基因型之间的显著差异(图S3A)。在HFD小鼠中,骨骼表型的变化不明显(图S3B和S3C),并且骨体积、皮质厚度、骨小梁数量和Ocys数量都未显著增加。总之,这些发现指出脂肪细胞Sucnr1条件敲除可能间接影响后天生长和骨发育,解释了基因型之间初始体重的差异。
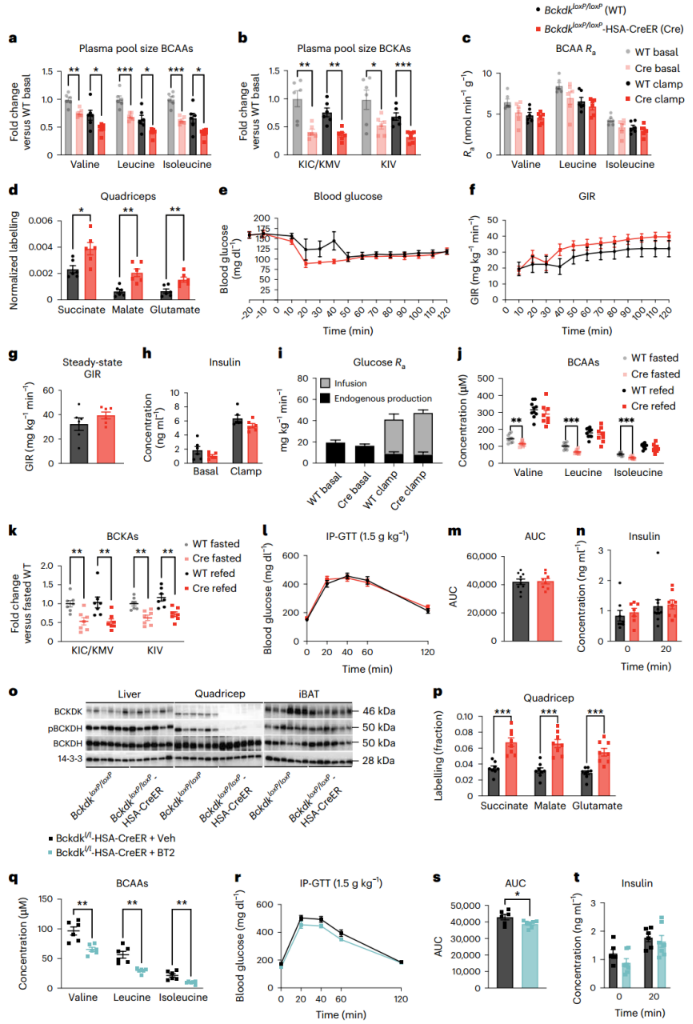
图3. SM中BCAA氧化增加不影响各种HFDs喂养小鼠的胰岛素敏感性
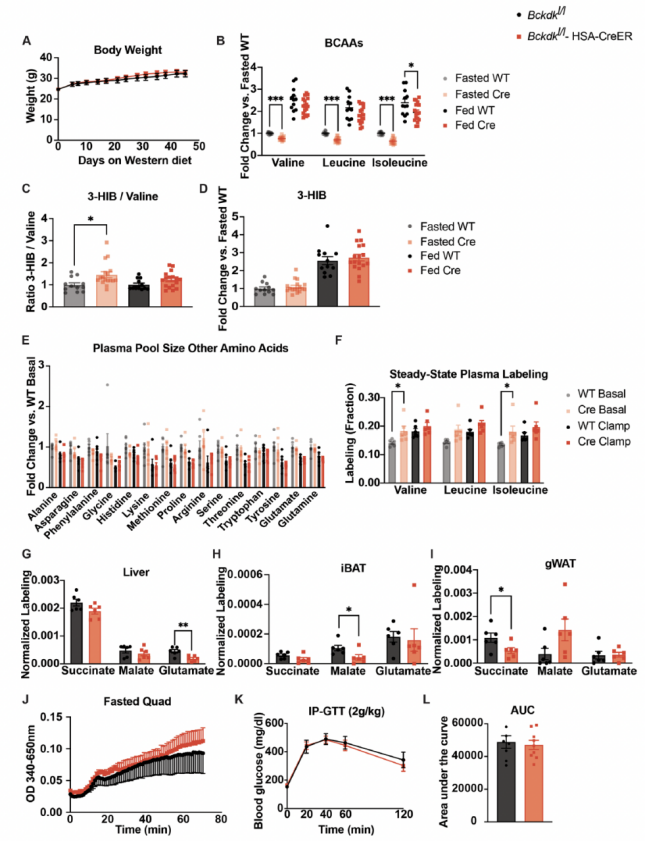
附图3.在禁食状态下SM中BCAA氧化的特异性增加不影响西方饮食小鼠的体重或葡萄糖耐量
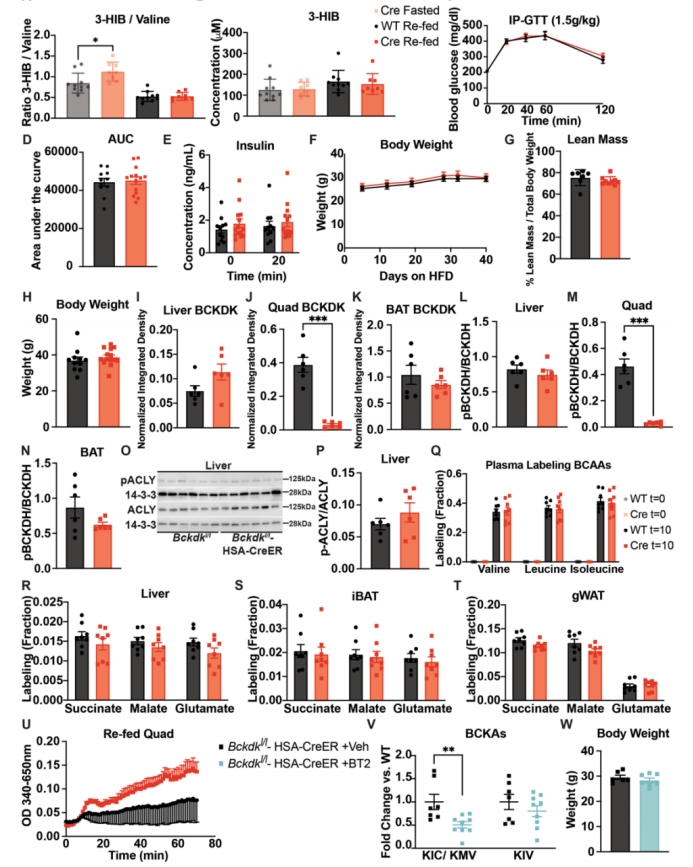
附图4.在饱食状态下SM中BCAA氧化的特异性增加不影响HFD小鼠的体重或葡萄糖耐量
4. 降低SM中BCAA的氧化不影响正常喂养小鼠的胰岛素敏感性
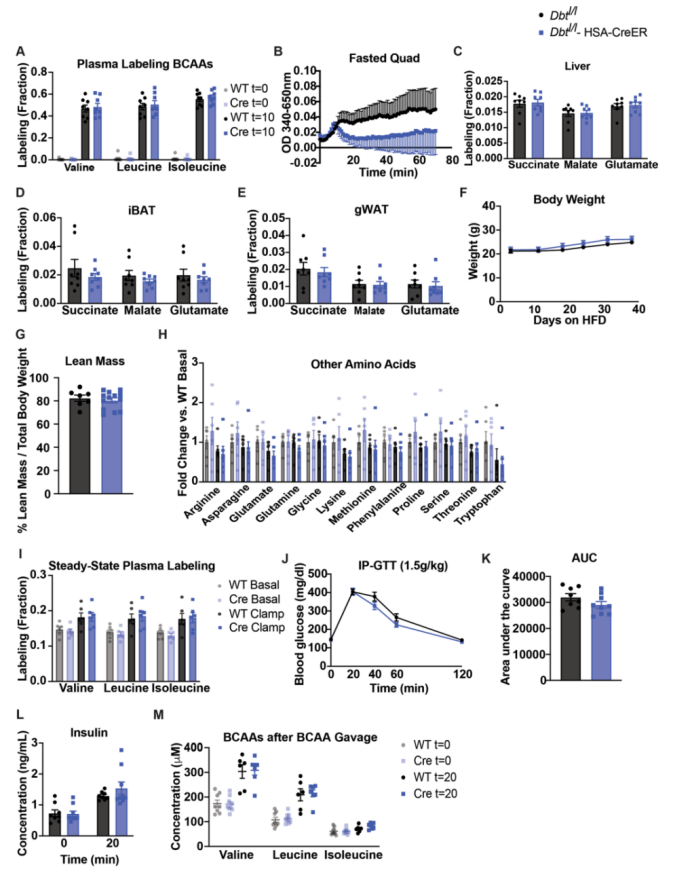
为了测试SM中的BCAA氧化缺失对胰岛素敏感性的影响,作者使用CRISPR-Cas9在小鼠Dbt两端引入loxP位点,并将其与编码HSA-Cre的小鼠杂交,产生他莫昔芬诱导的SM Dbt条件性敲除小鼠(DbtloxP /loxP-HSA-CreER)(小编注:Dbt是编码BCKDH 复合物E2成分的基因,文中以此产生BCKDH功能缺失的小鼠)。在他莫昔芬诱导后,Dbt的mRNA表达降低,并且蛋白质印迹法证实了DbtloxP /loxP-HSA-CreER小鼠的股四头肌和膈肌中DBT蛋白的缺失。然而,BCKD亚基Bckdha和Bckdhb 的mRNA水平以及BCKDHA的蛋白表达在组间无差异(图4a和附图5a-g)。DbtloxP /loxP-HSA-CreER小鼠表现正常,SM的H&E染色也未见异常(图4b和附图5h)。且组间体重无差异(附图5i)。令人惊讶的是,饥饿或再进食组小鼠的血浆BCAA、3-HIB与缬氨酸的比值和3-HIB浓度在组间均无差异(图4c和附图5j,k)。这表明其他组织可能出现代偿作用。接下来,作者通过给小鼠灌胃BCAA,来检测DbtloxP /loxP-HSA-CreER小鼠清除BCAA的能力。与对照组相比,DbtloxP /loxP-HSA-CreER小鼠在灌胃后血浆中的BCAA和BCKA清除能力显著减弱(图4d-m),表明全身BCAA分解代谢能力降低。
作者使用GTT试验和HIEC试验评估了这些小鼠的胰岛素敏感性。DbtloxP /loxP-HSA-CreER小鼠和对照小鼠在GTT实验中对葡萄糖的反应和胰岛素浓度均无差异(附图5l-n)。在HIEC中,尽管两组小鼠在钳夹过程中明显表现出高胰岛素血症,但他们在GIR和胰岛素浓度方面没有差异(图4n-q)。另外,虽然两组小鼠对血浆中BCAA和BCKA的清除能力存在显著差异,但DbtloxP / loxP-HSA-CreER小鼠的胰岛素敏感性与正常喂养的对照小鼠相比没有显著差异。
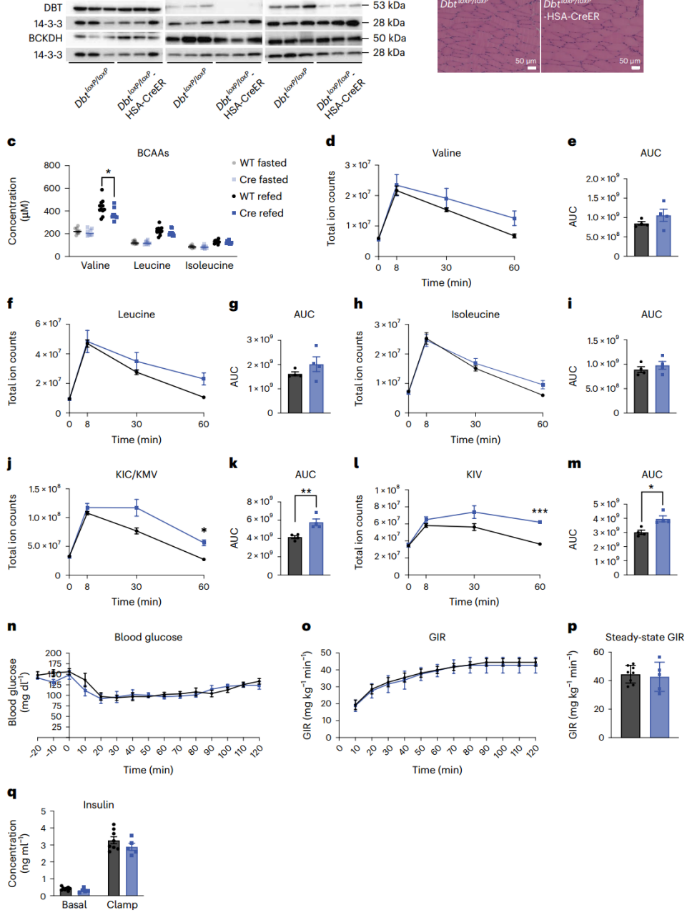
图4. SM中BCAA氧化减少不影响正常喂养小鼠的胰岛素敏感性

附图5. SM DBT特异性敲除不影响体重、肌肉生理和葡萄糖耐量
5. 降低SM中BCAA的氧化不影响HFD喂养小鼠的胰岛素敏感性
作者进一步研究SM中Dbt敲除对HFD喂养小鼠葡萄糖稳态的影响。在HFD喂养5周后,给小鼠灌胃[U-13C]标记的BCAA。10min后,与对照组相比,来自BCAAs标记的13C在DbtloxP/loxP-HSA-CreER小鼠股四头肌中TCA循环中间体的富集减少(图5a),而血浆中BCAAs的标记相同(附图6a),表明SM中BCAAs的氧化减少。禁食小鼠股四头肌BCKDH活性测定证实SM氧化活性降低(附图6b)。肝脏、iBAT和gWAT中标记的TCA循环中间体在两组之间没有差异(附图6c-e),组间体重和瘦肉质量也无差异(附图6f、g)。与正常喂养的Dbt loxP/loxP--HSA-CreER小鼠一样,饥饿组小鼠的空腹血浆BCAAs、BCKAs和再进食组小鼠的BCAAs均无变化(图5b,c)。
接下来,作者将HIEC与[U-13C]标记的BCAAs稳态输注相结合,在HIEC之前和期间对BCAA的Ra进行量化。在HIEC之前和期间,Dbt loxP/loxP--HSA-CreER小鼠的空腹血浆BCAAs、BCKAs和其他AAs与对照组间没有差异(图5d、e和附图6h)。[U-13C]标记的BCAAs在HIEC之前和期间均达到稳态,各组之间没有差异(附图6i);各组间BCAA Ra也无差异(图5f)。如上述图3c观察到的现象,在HIEC期间胰岛素输注再次降低了BCAA Ra。尽管有明显的高胰岛素血症,但在HIEC期间,Dbt loxP/loxP--HSA-CreER和对照组间的GIR和胰岛素浓度没有差异(图5 - j),HIEC之前进行的GTT显示,两组间葡萄糖耐量或胰岛素浓度无差异(附图6j - 1)。进一步研究发现,在GTT期间加入葡萄糖的同时给予BCAA急性刺激,葡萄糖耐量并未出现明显变化(图5k, 1)。在给予BCAA刺激20min后,GTT期间BCAA循环增加(附图6m)。而给予慢性BCAA刺激可能会显示不同的结果。丙酮酸耐量试验(PTT)显示,丙酮酸负荷后各组间血糖无差异,表明SM中敲除Dbt后不影响肝糖异生(图5m,n)。综上所述,降低SM中BCAAs的氧化对正常喂养或HFD小鼠或给予BCAA刺激的小鼠的胰岛素敏感性没有影响。
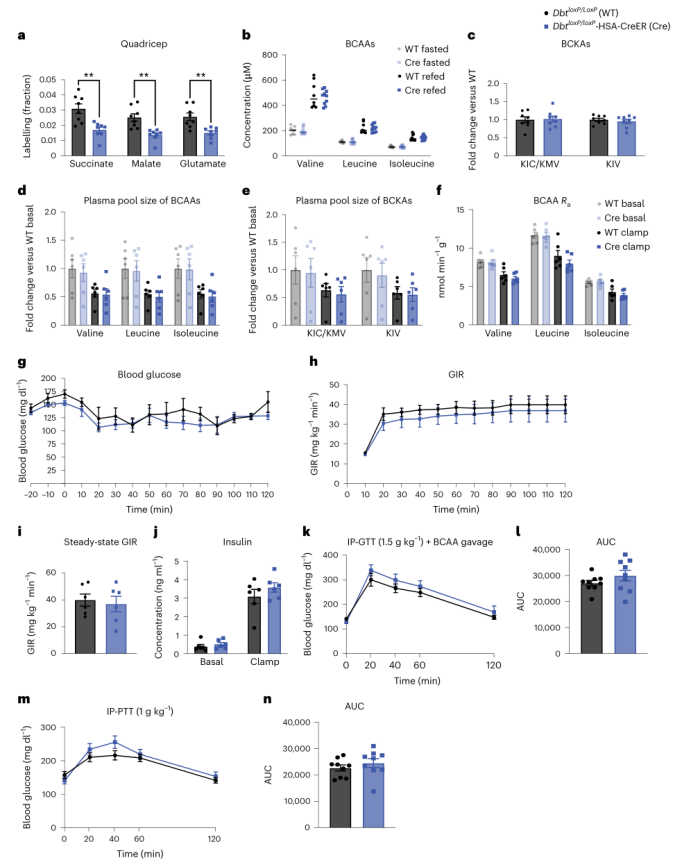
图5. SM中BCAA氧化减少不影响HFD喂养小鼠的胰岛素敏感性
附图6. SM BCAA氧化降低是特异性的,不影响HFD喂养小鼠的体重或葡萄糖耐量
6. 增加肝脏BCAA氧化不影响HFD喂养小鼠的胰岛素敏感性
以往研究表明,增加ZFR大鼠肝脏BCAA的氧化水平可改善胰岛素敏感性;在前面研究中作者发现SM中BCAA分解代谢的调节对胰岛素敏感性没有影响,所以作者试图增加HFD喂养小鼠肝脏中的BCAA氧化来改善胰岛素敏感性。于是,作者利用嗜肝病毒AAV8-TBG-Cre(AAV8-TBG-Cre在肝细胞特异性甲状腺素结合球蛋白TBG启动子下编码Cre,从而特异性敲除肝实质细胞中Bckdk感染Bckdk loxP/loxP小鼠以敲除肝脏中的Bckdk;对照组给予AAV8-TBG-GFP。结果显示病毒注射可敲除肝脏BCKDK,降低pBCKDH 的表达(图6a和附图7a-f)。饥饿和再进食小鼠的血浆BCAAs、BCKAs以及体重均无差异(图6b、c和附图7g)。然而,在输注[U-13C]标记的BCAAs后,与对照小鼠相比,Bckdk敲除小鼠肝脏中的BCAAs显著减少(图6d),但这些小鼠肝脏中的BCKAs没有差异(图6e)。而各组小鼠在BCAA输注后血浆中标记的BCAAs是相同的(附图7h),虽然蛋白质印迹实验的结果显示肝脏中的Bckdk已被敲除,但饥饿组小鼠肝脏中标记BCAAs衍生的TCA循环中间体在两组之间没有差异(图6f)。这可能是因为原本肝脏中的pBCKDH已经很低了,所以即便敲除Bckdk也不会进一步增加BCKDH的活性。肝脏中Bckdk敲除对股四头肌、iBAT或gWAT中标记的TCA循环中间体也没有影响(附图7i-k)。BCKDH活性测定显示,Bckdk肝敲除组BCKDH活性与对照组相比略有增加(附图71)。为了评估胰岛素敏感性,作者在喂养HFD后的2周、4周和2个月分别进行了GTT,结果发现各组在任何时间点的糖耐量和胰岛素浓度均无显著差异(图6g-m)。在BCAA急性输注20min后,葡萄糖耐量没有差异,循环血浆中BCAAs水平升高(附图7m - o)。慢性BCAA输注可能会显示出不同的结果,但作者没有进行这部分研究。综上所述,肝脏中敲除Bckdk对HFD喂养小鼠的胰岛素敏感性没有影响。
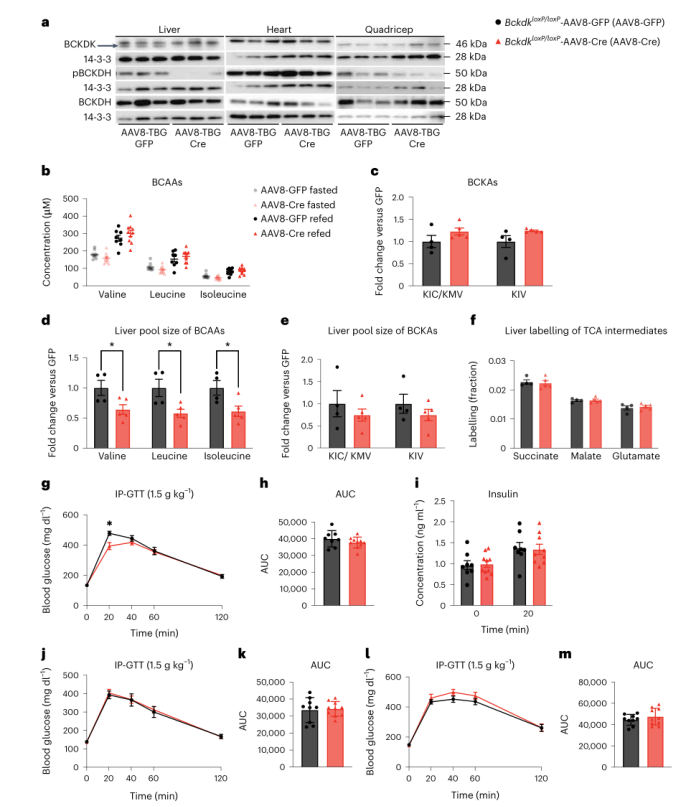
图6. 肝脏BCAA氧化增加不影响HFD喂养小鼠的胰岛素敏感性

附图7. 肝脏BCKDK敲除不影响HFD或BCAA刺激后的不同时间点的小鼠体重或糖耐量
7. 降低肝脏BCAA氧化不影响正常喂养或HFD喂养小鼠的胰岛素敏感性
作者利用AAV8-TBG-Cre靶向敲除Dbt loxP/loxP小鼠肝脏中的Dbt基因,以研究肝脏BCAA分解代谢丧失对胰岛素敏感性的影响。AAV8-TBG-Cre可有效敲除小鼠肝脏中的Dbt(图7a和附图8a-c),在正常喂养和HFD喂养条件下,对照组和敲除小鼠的体重均无差异(附图8d)。正常喂养小鼠的饥饿和再进食状态下,血浆BCAAs无显著差异(图7b),Dbt肝敲除组与对照组的葡萄糖耐量或胰岛素浓度也没有差异(图7c-e)。在HFD喂养4周后,各组间饥饿和再进食小鼠血浆BCAAs或饥饿状态下的BCKAs均无差异(图7f,g)。给予[U-13C]标记的BCAAs 刺激10min后,各组间BCAAs的肝池大小无显著差异(图7h),但与HFD喂养对照组相比,Dbt肝敲除组肝脏BCKAs的浓度增加(图7i)。血浆中标记的BCAAs在两组之间没有差异(附图8e),但在Dbt肝敲除组中,饥饿状态下肝脏中[U-13C]标记的BCAAs衍生的TCA循环中间体减少(图7j),各组之间在饥饿状态下的股四头肌、iBAT或gWAT中标记的TCA循环中间体没有差异(附图8f-h)。BCKDH活性测定证实,与对照组相比,Dbt肝敲除后空腹肝脏的BCKDH活性显著降低(附图8i)。同样,在HFD喂养条件下,各组之间葡萄糖耐量或胰岛素浓度没有差异(图7k-m)。急性BCAA刺激后,葡萄糖耐量和胰岛素浓度也没有差异,开始GTT 20min后,循环血浆BCAAs升高(附图8j-m)。慢性BCAA刺激可能会显示不同的结果,但作者没有进行这部分研究。综上所述,降低BCAAs在肝脏中的氧化水平对正常或HFD喂养的小鼠或急性输注BCAA的小鼠的胰岛素敏感性没有影响。
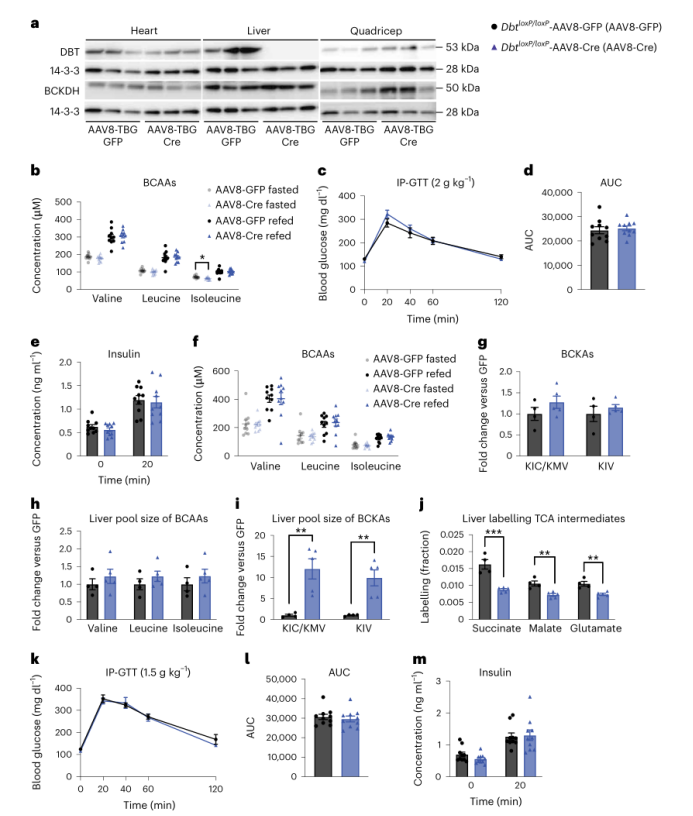
图7.肝脏BCAA氧化减少不影响正常喂养或HFD喂养小鼠的胰岛素敏感性

附图8. 肝脏DBT敲除不影响多种饮食或BCAA刺激后的体重、葡萄糖耐量
8. 在SM和肝脏中双敲除BCKDK对胰岛素敏感性没有影响
为了研究同时改变肝脏和SM中BCAA的氧化是否能改善胰岛素敏感性,作者用AAV8-TBG-Cre注射Bckdk loxP/loxP -HSA-CreER小鼠,产生SM和肝脏中BCKDK双敲除小鼠,同时利用AAV8-TBG-GFP感染小鼠作为对照组。BCKDK在股四头肌和肝脏中均被敲除;pBCKDH也减少(图8a和附图9a-h)。饥饿组小鼠肝脏的pACLY或ACLY在两组间并无差异(附图9i,j),各组间体重和瘦肉质量也无差异(附图9k, 1)。在HFD喂养6周后,各组间的葡萄糖耐量或胰岛素浓度没有差异(图8b-d。与对照组相比,BCKDK双敲除组的空腹血浆BCAAs显著降低(图8e),而肝脏中BCKDK敲除并未降低血浆BCAAs,所以BCKDK双敲除组中的循环BCAAs并不低于Bckdk loxP/loxP -HSA-CreER单敲除组中的循环BCAAs(图8e)。3-HIB/缬氨酸的比值在饥饿状态下显著升高,而再进食状态下无显著升高,各组间3-HIB浓度相同(附图9m,n)。小鼠肝脏和股四头肌中的BCKDK和pBCKDH也减少(图8f和附图90 - v);小鼠肝脏的pACLY和ACLY在两组间也没有差异(附图9w,x)。综上所述,SM和肝脏中BCAA氧化增加对胰岛素敏感性没有影响。
最后,为了测试BT2是否通过肌肉和肝脏以外的组织起作用,作者分别用BT2和对照溶液急性处理BCKDK双敲除小鼠。与对照组相比,用BT2处理能显著改善BCKDK双敲除小鼠的葡萄糖耐量(图8g,h),而组间胰岛素浓度和体重没有差异(图8i和附图9y)。在BCKDK双敲除小鼠中,BT2处理后进一步降低了小鼠饥饿和再进食状态下的BCAAs(图8j)。以上结果表明,BT2可以作用于SM和肝脏以外的组织,降低全身BCAAs,改善胰岛素敏感性。
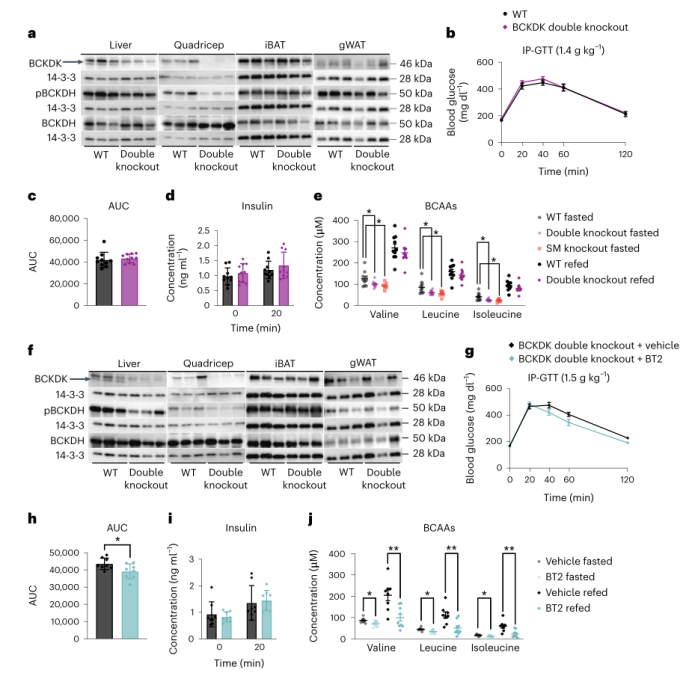
图8. 在SM和肝脏中双敲除BCKDK对胰岛素敏感性没有影响

附图9. SM和肝脏中BCKDK双敲除在禁食和再喂养状态下是特异性的
总结
前期研究表明,血浆BCAAs升高可导致IR和T2D的发生。BT2抑制BCKDK可增加啮齿动物全身BCAA氧化水平并改善胰岛素敏感性,且最近的一项人类研究显示,苯丁酸钠(一种BT2类似物,也能抑制BCKDK)治疗可改善T2D的胰岛素敏感性。本文就BCAAs促进IR的机制,以及BT2和苯基丁酸钠作用于什么组织以改善胰岛素敏感性的机制进行了探究。
作者发现,在SM Bckdk敲除组中,降低饥饿状态下的BCAAs水平并没有改善胰岛素敏感性。此外,作者在三种不同的饮食环境(正常喂养、HFD喂养、西方饮食喂养)(小编注:HFD与西方饮食的异同:1.饮食成分不同:西方饮食模型是将小鼠喂养高脂肪、高糖、低纤维的饮食,而HFD模型则是将小鼠喂养高脂肪、高糖、高热量的饮食。2.对健康影响不同:西方饮食模型可以导致小鼠发生肥胖、胰岛素抵抗、脂肪肝等代谢异常,但其发病机制与人类肥胖相关的代谢疾病不完全一致。而HFD模型则更适合研究肥胖与代谢相关的生理和病理机制,因为其饮食成分更接近人类肥胖的饮食习惯)中也证明了这一点。在三种情况下,饥饿状态下小鼠血浆中的BCAAs和BCKAs水平显著降低,但不影响胰岛素的敏感性。所以,尽管空腹血浆BCAA水平与T2D的发展存在长期联系,但胰岛素敏感性不太可能受空腹全身BCAA水平调节。本文的研究模型只降低了饥饿小鼠血浆中的BCAAs水平,而BT2处理降低了饥饿和再进食组小鼠的血浆BCAAs。这可能说明饲喂期间BCAAs负荷增加,对于SM和肝脏来说,BCAAs负荷太大,无法快速分解代谢。因此,饲喂后血浆BCAA可能在IR中起作用。作者得出结论,血浆BCAAs不是IR的驱动因素,这与实验结果一致,即小鼠体内Bcat2的系统性缺失导致血浆BCAAs升高,导致胰岛素敏感性增加。
接下来,作者对促进BCAAs对IR的影响的作用位点进一步展开讨论。以往研究表明,SM是BCAAs对IR影响的主要作用位点。然而,在本研究中,作者发现,SM中BCAA的氧化激活和抑制对胰岛素敏感性都没有明显的影响,这说明虽然SM是BCAA氧化的主要组织部位,但SM 中BCAA氧化对小鼠IR的影响很小。此外,与SM一样,肝脏BCAA氧化对小鼠胰岛素敏感性的影响也很小。并且在SM或肝脏中,单独或联合敲除Bckdk对胰岛素敏感性都没有影响,这表明BT2的有益作用必须通过不同的组织来介导。
一些研究表明,补充BCAA会恶化胰岛素敏感性,这可能与BCAA途径有关。本研究证明SM或肝脏中的BCAA氧化,单独或联合敲除Bckdk对胰岛素敏感性都没有影响,即降低空腹血浆中BCAA水平不足以改善胰岛素敏感性,而BCAA氧化的全身激活却能发挥有益作用。但该种作用机制仍不明确。
关注微信公众号代谢学人
了解更多代谢前沿资讯

https://m.sciencenet.cn/blog-3483272-1402724.html
上一篇:Cell:线粒体还原应激“守门员”
下一篇:代谢学人--Nature:节食未必瘦?GDF15来报道!