博文
华中科大高尚邦课题组报道胆囊收缩素信号调控本能逃避行为
||
北京时间2022年2月9日凌晨0时,华中科技大学高尚邦课题组在Cell Reports期刊发表了题为“Escape Steering by Cholecystokinin Peptidergic Signaling” 的研究论文,发现了调控饱足感的胆囊收缩素受体信号在本能逃避行为中的重要作用。

该研究以线虫受到强伤害性刺激时表现出的快速后退、转向、再前进的逃避运动序列,为实验范式,通过对线虫逃避转向进行精确量化分析,发现线虫逃避伤害刺激时伴随的几乎180°的转向(robust steering)运动,需要激活胆囊收缩素信号通路。转向调节需要的神经肽NLP-18由味觉感受神经元ASI释放,激活下游头部运动神经元SMD和中间神经元AIB上的胆囊收缩素样受体CKR-1。实时追踪自由逃避转向时的SMD神经元钙活动,证明NLP-18-CKR-1信号通路可以增强线虫在转向时SMD神经元的钙活性,从而为头部肌肉提供更强的动力完成180°转向 (full Ω-turn)。(图1)
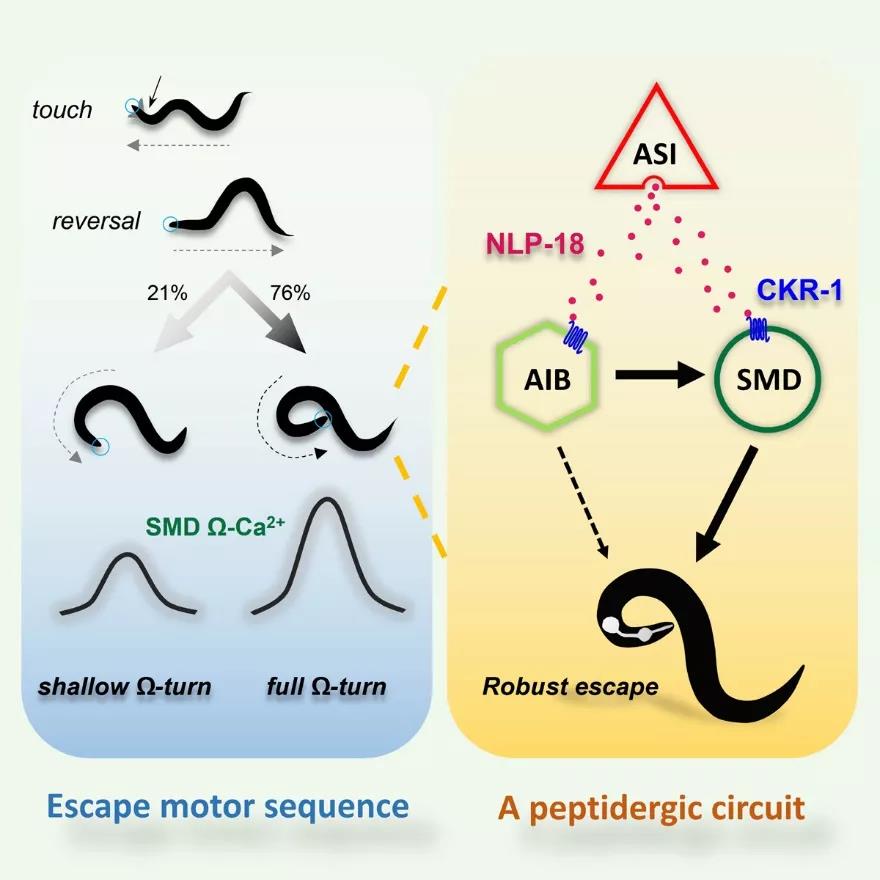
Fig 1. 本能逃避行为调控的神经环路和神经肽分子机制。
该工作揭示了在时程上慢释放、慢响应著称的神经调质(神经肽)信号通路,在快速逃避行为中也发挥着关键作用,为研究固有本能行为的神经环路与分子调控机制提供了新的思路。
华中科技大学博士生陈丽丽、柳玉婷为论文共同第一作者。华中科技大学生命科学与技术学院高尚邦教授为论文通讯作者。加拿大多伦多大学Mei Zhen教授和Wesley Hung,北京大学毛珩、陶乐天教授,以及华中科技大学陈历明教授、费鹏教授、张燕教授和吴政星教授参与本项目研究指导。研究生苏攀、李海文、王涯、岳中谱、葛明海对本研究做出了重要贡献。
逃避行为是几乎所有动物都与生俱来的、进化上保守的本能行为。从低等到高等生物,当遇到伤害性刺激时,都会触发它们做出尽可能快的逃避反应,从而远离危险。逃避行为一般具有如下特性:响应快速、动作连贯、模式固定。快速的逃避响应往往依赖于快速释放的神经递质和电突触;连贯的动作包括后退、转向和逃离等运动序列;固定的模式指上述连贯的运动序列发生的顺序、时程和幅度等相对不变。神经系统如何高效完成逃避反应?完整的逃避过程需要感觉神经、中间整合神经、以及运动神经系统的交互协调,除了快速传递神经信号的神经递质外,是否还有其它分子也在逃避本能行为中发挥作用?研究本能行为中神经调质的作用机制对于了解大脑高级功能具有重要意义。
缩胆囊素信号肽主要包括胆囊收缩素(Cholecystokinin, CCK)和胃泌素(Gastrin)等酪氨酰磺酸化多肽家族成员,具有保守的羧基末端八肽序列。信号肽通过激活缩胆囊素受体(CCK receptor)发挥激素调节和神经递质的作用。CCK受体包括A和B两个亚型(CCKAR和CCKBR),广泛表达在肠胃、胰腺、胆囊等消化系统器官,也大量分布在外周和中枢神经系统。CCK受体广泛参与调控包括饱腹感、胰酶分泌和胆囊收缩等食欲相关的生理功能,并在神经系统疾病,如记忆障碍、药物成瘾和焦虑症等中发挥重要作用。
研究者通过对野生型线虫头部施加强烈的机械刺激(harsh touch),触发固有逃避行为,观察到线虫稳定的连续逃避运动序列:后退运动,多角度重定位的转向运动,前进运动。对约150条线虫的逃避行为量化分析后发现,76.3% 的线虫转向时头部会有一个180°的转向重定位(full Ω-turn),21% 的线虫则是表现出较小角度的头部重新定位(shallow Ω-turn),剩下很小部分(~2.7%)线虫没有转向运动(图2A)。由此判断线虫快速的逃避反应既包含稳健性也兼顾灵活性,那么其内在的调节神经环路与分子机制是什么呢?
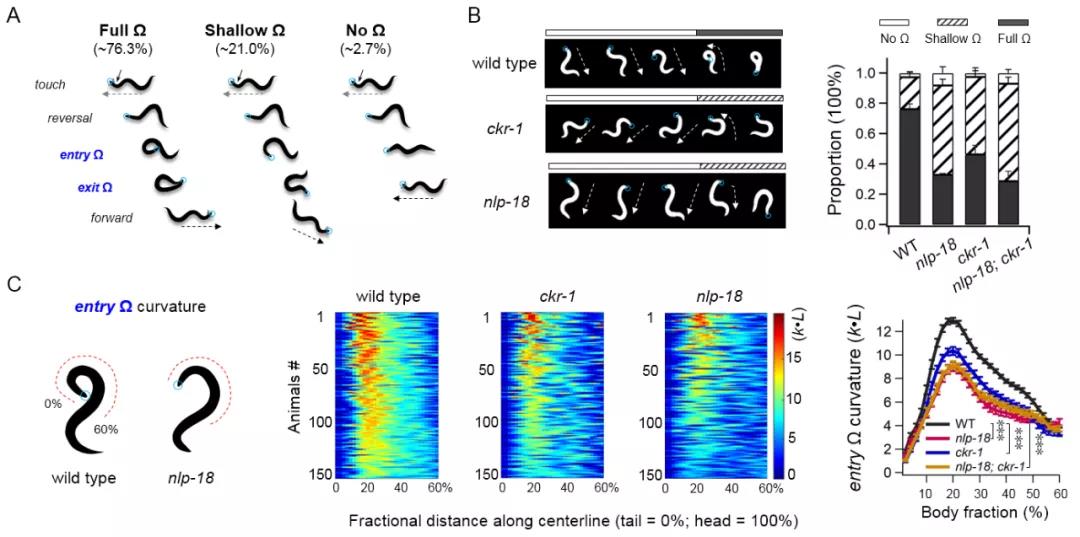
Fig 2. 线虫本能逃避行为调控需要nlp-18和ckr-1。
遗传筛选发现,神经肽配体基因nlp-18、胆囊收缩素样受体基因ckr-1突变体,表现出shallow Ω-turn的比例显著增多,相对应的full Ω-turn的比例显著下降(图2B),同时转向曲率也明显减弱(图2C)。利用转基因表达以及基因回补实验,研究者发现nlp-18表达在ASI感觉神经元中,且在nlp-18突变体中仅在ASI神经元上过表达NLP-18,可以挽回基因功能缺失带来的转向缺陷。将CKR-1表达在调节头部肌肉的运动神经元SMD和调控后退的中间神经元AIB中也可以很好回补ckr-1突变体的转向缺陷。为了进一步确认ckr-1的神经元功能特异性,研究者还结合ZIF-1-ZF1系统,特异性敲低SMD和AIB神经元上的CKR-1蛋白水平,线虫也表现出和ckr-1突变体类似转向缺陷。值得注意的是,逃避转向的角度往往和逃避初段的后退距离有关,后退距离越短,full Ω-turn比例越低。但研究发现,无论是后退时间还是后退距离,在nlp-18,ckr-1, 亦或是nlp-18;ckr-1双突变体中都没有变短,有的甚至变长,说明nlp-18,ckr-1并非通过调控后退距离来调节转向。结合前文叙述,该研究结果说明胆囊收缩素信号选择性调控逃避转向动作。
为了更直观的观察NLP-18和CKR-1在逃避转向过程中对SMD神经元的调控,研究者制备转基因线虫,将钙敏感蛋白GCaMP表达在SMD运动神经元上,并对SMD神经元在转向时的钙活性进行实时追踪成像。研究发现SMD的钙活性在做full Ω-turn时会明显增高,但这个现象在两个突变体中明显减弱(图3)。且在ASI神经元过表达NLP-18或在SMD神经元过表达CKR-1都能将减弱的SMD钙活性特异拯救回来,说明NLP-18-CKR-1信号通路确实直接调控了SMD的细胞活性。
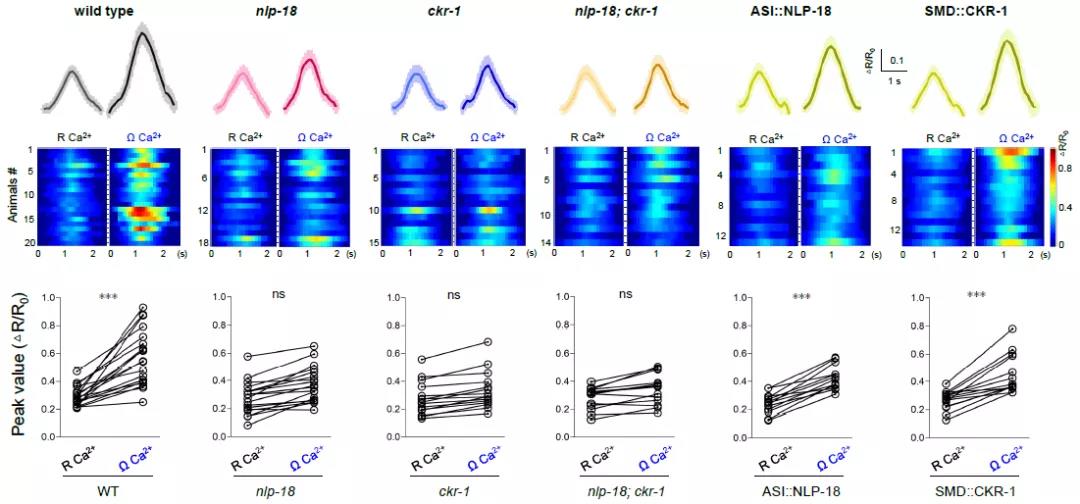
Fig 3. NLP-18-CKR-1信号通路调控SMD运动神经元转向钙活性。
为了拿到NLP-18直接激活CKR-1的证据,研究者采用两种更特异的手段进行了进一步研究:外源表达和内源激活。首先研究者利用非洲爪蟾卵母细胞外源表达CKR-1受体,灌流人工合成的NLP-18神经肽,能在细胞上记录到稳定的电流,说明NLP-18能够直接激活CKR-1(图4AB)。内源实验则采用线虫在体解剖的方法,暴露SMD神经元并灌流人工合成NLP-18多肽,在SMD神经元上同样记录到配体依赖的强烈钙信号(图4CD)。自此,实验直接证明NLP-18与CKR-1是一对配受体。研究者还通过遗传学、行为学结合测钙技术,发现阻断CKR-1下游的GPCR信号通路中的Gαq蛋白的同源物EGL-30,配体激活的钙信号消失,证明了CKR-1是一个Gαq蛋白偶联受体。
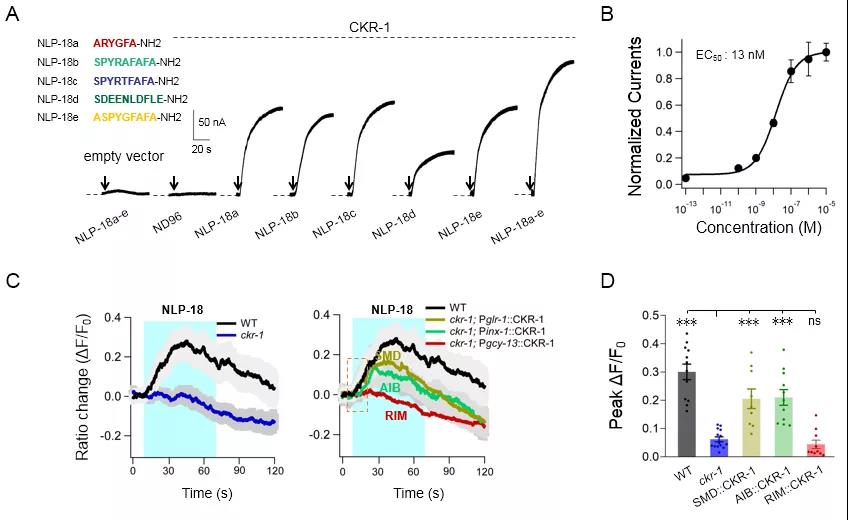
Fig 4. CKR-1是NLP-18神经肽的内源受体。
简言之,该工作发现,主要调控饱足和焦虑感的胆囊收缩素受体及其信号通路,在快速的逃避转向运动中也发挥关键作用。本文不仅促进了胆囊收缩素信号通路的多功能研究,还发现调控慢时程的神经调质(神经肽)信号在快速运动神经系统中的重要作用。
通讯作者介绍
高尚邦,理学博士,华中科技大学生命科学与技术学院教授,博士生导师。依托分子生物物理教育部重点实验室,重点研究运动产生、维持和调控的神经环路与分子机制。研究团队正在运动传导速率机制以及全脑成像等方面开展进一步研究工作,欢迎感兴趣的研究生和博士后加盟!请邮件联系:sgao@hust.edu.cn
(http://faculty.hust.edu.cn/gaoshangbang/zh_CN/index.htm)
相关论文信息:
https://doi.org/10.1016/j.celrep.2022.110330
https://m.sciencenet.cn/blog-3423233-1324596.html
上一篇:张冬卉/李一飞/蒋卫团队联合揭示早期胚层发育中线粒体作用机制
下一篇:南科大欧西军课题组揭示剪接子相关成分在B细胞发育中的调控作用及机制