博文
代谢学人--Nature Metabolism:/斜杠青年/这个表观修饰酶还管食欲!
||
代谢学人
/斜杠青年/这个表观修饰酶还管食欲!

撰文 | 郑宇含 刘秀玉 王佳雯 张婷 李雨
编辑 | 孟美瑶
校对 | 张彦康
背景介绍
能量摄入与消耗的失衡导致肥胖发生,表现为体内脂肪的过度积累。已有研究表明瘦素(leptin)及其受体所介导的信号通路在能量代谢与食欲调节中发挥了重要作用。瘦素是一种由脂肪组织分泌的激素,它在血清中的含量与动物脂肪组织大小成正比。瘦素能够与中枢神经系统中的瘦素受体结合,随后通过激活JAK/STAT和MAPK等信号通路而释放类似于“我吃饱了”的信号,从而抑制食物摄入;在体脂下降的时候,会导致瘦素分泌减少,则会释放“我饿了”的信号,食物摄入增加。随着研究的深入,越来越多的证据表明肥胖患者体内瘦素含量往往异常上升,而瘦素敏感性下降,出现“瘦素抵抗”现象。
HDAC6是组蛋白去乙酰化酶家族成员,具有丰富的功能,不仅可以在核内调控组蛋白去乙酰化修饰,还可以在胞质中调控非组蛋白去乙酰化修饰,以及非酶作用。在正常情况下,HDAC6定位于细胞质,调控非组蛋白去乙酰化修饰,或发挥非酶作用;在一些疾病,例如神经退行性疾病中,HDAC6会入核,调控组蛋白去乙酰化修饰,从而调控基因转录。如HDAC6通过降低肌动蛋白结合蛋白(非组蛋白)的乙酰化水平,促进其与肌动蛋白结合,从而促进细胞运动。HDAC6入核后可以通过参与转录抑制,从而抑制细胞分化、增殖等,如ApoE4水平升高可上调神经退行性疾病的发生风险,在神经退行性疾病中,ApoE4即可促使HDAC6入核,与BDNF(突触修复的关键因子)的启动子结合,抑制BDNF的转录表达,从而使神经元受损。同时,HDAC6也调控蛋白质稳态,通常可以与蛋白酶体降解相关蛋白相互作用,从而调控蛋白聚集体和应激颗粒的形成、自噬、热休克反应以及线粒体自噬等反应,如HDAC6的C端结构域可以与泛素化蛋白酶体结合,从而抑制泛素化蛋白的降解。有趣的是,近年来有许多研究发现蛋白稳态失调与代谢紊乱紧密相关,肥胖与代谢性疾病的发生通常伴随着自噬、热休克反应以及泛素-蛋白酶体信号的异常。例如运动会增加自噬水平,从而使细胞通过蛋白质分解代谢来适应机体的营养和能量需求,而自噬受损的小鼠在急性运动期间表现出骨骼肌的胰岛素敏感性下降,葡萄糖利用率降低;但也有研究发现,骨骼肌中自噬受体缺失的小鼠脂肪含量减少,并且在高脂饮食下不会产生肥胖或胰岛素抵抗现象,这提示骨骼肌自噬缺陷可能会引起其他胰岛素靶组织的代偿性改善。考虑到HDAC6具有调控蛋白质稳态的作用,HDAC6是否在能量稳态和代谢调控方面也发挥着重要作用,还有待进一步研究。
近期发表在Nature Metabolism杂志上的“Histone deacetylase 6 inhibition restores leptinsensitivity and reduces obesity”文章中,研究人员利用肥胖小鼠为模型发现HDAC6抑制剂Tubastatin能通过抑制脂肪组织内HDAC6酶活性而提高中枢对瘦素的敏感性,进而降低肥胖小鼠的体重、体脂与摄食量,并改善代谢稳态。

敲黑板啦!
1. Tubastatin能够有效缓解肥胖
2. Tubastatin可显著改善代谢稳态
3.Tubastatin需要瘦素信号发挥作用
4. HDAC6以细胞非自主的方式调节体重
研究结果
为了研究HDAC6在能量稳态中的潜在作用,研究人员利用了药理学手段靶向抑制HDAC6的去乙酰化酶活性。Tubastatin A(Tubastatin)属于羟肟酸化合物,是HDAC6的选择性抑制剂,Tubastatin对HDAC6的敏感性是对其他HDAC敏感性的1000倍以上(HDAC8除外,Tubastatin对HDAC6的敏感性是HDAC8 的50倍以上)。如今Tubastatin已被设计为可简单合成的药物样结构,并在小鼠体内确定了药代动力学。此外,Tubastatin同时兼具保护机体免受氧化应激,以及抗炎和神经保护的作用。因此,研究人员选择使用Tubastatin来靶向抑制HDAC6去乙酰化酶活性。
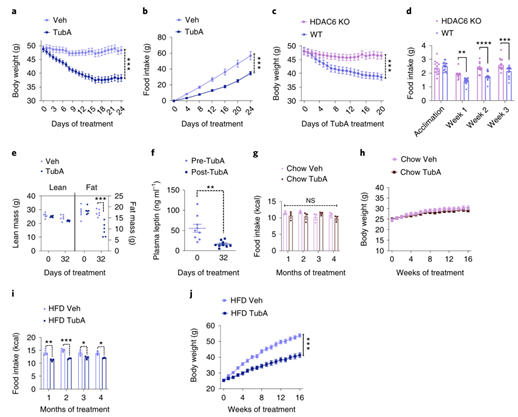
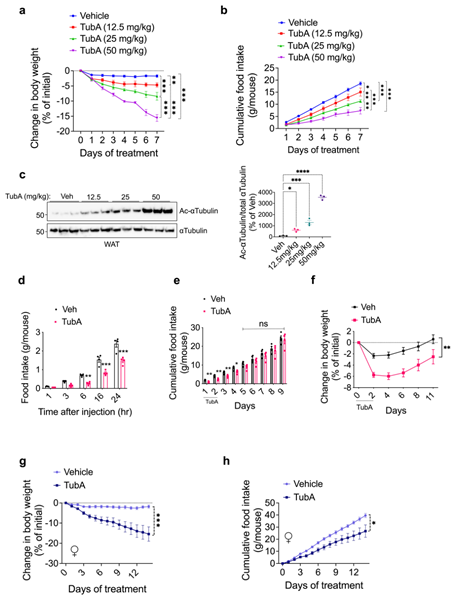
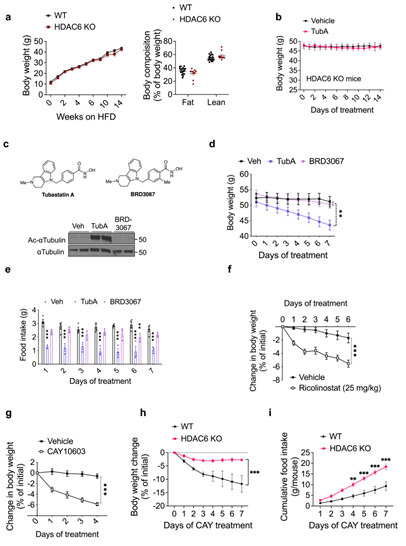
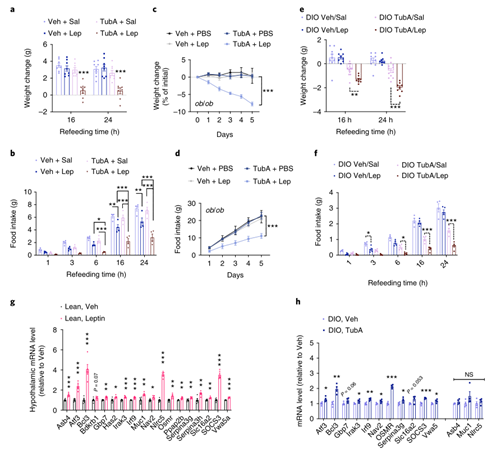
首先研究人员利用由HFD喂养16-20周所诱导的DIO雄鼠来分析Tubastatin的作用,对DIO小鼠每天腹腔注射Tubastatin,发现两周后小鼠体重出现显著下降(Fig.1a),摄食量也显著减少(Fig.1b),且这一效果随Tubastatin剂量增高更加显著(ExtendedData Fig. 1a-f)。同时研究人员还发现Tubastatin的抑制摄食减轻体重作用并不特异于DIO雄鼠,在DIO雌鼠中同样有效(ExtendedData Fig. 1g,h)。接下来,研究人员利用HDAC6 KO(HDAC6基因全身敲除)小鼠来验证Tubastatin的减肥作用是否依赖于HDAC6。首先,在HFD喂养下,HDAC6 KO小鼠的体重体脂与WT小鼠没有显著差异(ExtendedData Fig. 2a),这说明HDAC6基因敲除本身并不能缓解HFD诱导的小鼠肥胖。然而,与WT小鼠不同,每天腹腔注射Tubastatin并不能显著降低DIO HDAC6 KO小鼠的体重和摄食量(Fig. 1c,d andExtended Data Fig. 2b)。随后研究人员利用BRD3067(模拟无活性Tubastatin,不能抑制HDAC6的去乙酰化酶活性)处理DIO WT小鼠,发现其不能影响小鼠体重和摄食量(ExtendedData Fig. 2d,e),而利用其他2种HDAC6特异性抑制剂CAY10603和ricolinostat处理DIO WT小鼠后,显著降低了DIO小鼠的体重和摄食量(ExtendedData Fig. 2f-l),这表明Tubastatin通过抑制HDAC6来缓解DIO小鼠的肥胖现象。
通常禁食和食物限制会导致小鼠脂肪和瘦肉质量的减少。由于Tubastatin显著减少了DIO小鼠的摄食量,因此研究人员检测了Tubastatin治疗前后DIO小鼠的体脂变化,发现Tubastatin治疗没有显著改变DIO小鼠的瘦肉质量,但脂肪含量显著减少(Fig.1e),之前也有研究报道HDAC6 KO小鼠瘦肉质量不变。此外,Tubastatin治疗后,DIO小鼠血液中瘦素水平也显著降低(Fig.1f)。这表明Tubastatin治疗后降低了脂肪含量从而引起小鼠体重下降。
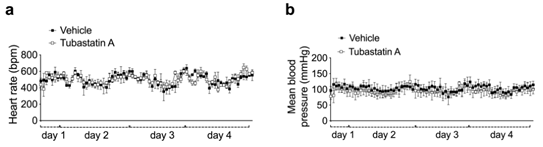
利用Tubastatin靶向抑制HDAC6可缓解DIO小鼠的肥胖现象,然而Tubastatin是否可以预防肥胖的发生呢?接下来,研究人员对WT小鼠进行连续4个月Tubastatin治疗,同时饲喂HFD饮食或者正常饮食,发现饲喂正常饮食的小鼠摄食量和体重,以及心脏指标(心率和血压)并没有发生明显变化(Fig.1g,h, Extended Data Fig. 3a,b),而Tubastatin治疗后HFD小鼠的体重和摄食量显著降低(Fig. 1i,j),表明Tubastatin治疗并不会影响正常饮食小鼠的体重,但可以预防HFD饮食小鼠的体重增长,说明利用Tubastatin靶向抑制HDAC6是一种有效的抗肥胖方法。
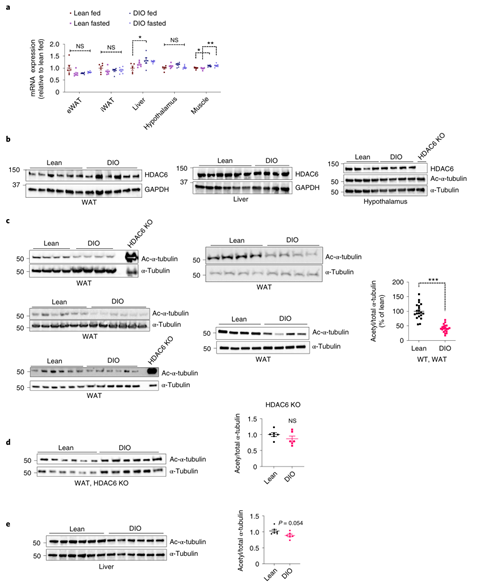
那么,HDAC6是如何影响肥胖小鼠的体重呢?研究人员首先分析了代谢组织(包括脂肪组织、骨骼肌、肝脏和下丘脑)中HDAC6的表达水平,发现在禁食或HFD处理下HDAC6的基因表达和蛋白表达水平均无明显变化(Fig. 2a,b)。有研究表明在肥胖条件下,脂肪组织中HDAC6酶活性会受到上游信号(如ERK1/2)的正调控而被激活。于是研究人员检测了代谢组织中HDAC6的酶活性变化(以α-微管蛋白乙酰化水平反映HDAC6酶活性),发现DIO小鼠脂肪组织中HDAC6活性显著升高(Fig.2c),肝脏和下丘脑中HDAC6酶活性并没有发生变化(Fig.2b,e),且全身敲除HDAC6基因后DIO小鼠脂肪组织中α-微管蛋白乙酰化水平与正常饮食小鼠并没有差异(Fig.2d),提示HDAC6本身水平变化并不会影响蛋白乙酰化水平,肥胖中观察到的目的蛋白乙酰化水平的变化是因为小鼠脂肪组织中HDAC6酶活性的上调,而利用Tubastatin靶向抑制HDAC6酶活性可有效缓解肥胖。
2.Tubastatin改善DIO小鼠代谢功能
饮食诱导的肥胖现象通常伴随脂肪异位堆积和糖稳态受损,而Tubastatin治疗后可显著降低DIO小鼠的血糖水平,且糖稳态也明显得到改善(Fig.3a-b),虽然Tubastatin治疗没有影响正常饮食小鼠的体重和摄食量,但小鼠的糖稳态也显著改善(Fig.3c),表明Tubastatin对糖稳态的影响并不依赖于体重。此外,Tubastatin治疗后DIO小鼠的脂肪肝也明显改善,且肝脏和脂肪组织中脂代谢相关基因以及肝脏中糖代谢相关基因表达下调 (Fig. 3d-g),同时脂肪组织中抗炎基因表达上调(Fig.3h)。表明Tubastatin处理可改善DIO小鼠肝脏和脂肪组织的代谢功能。
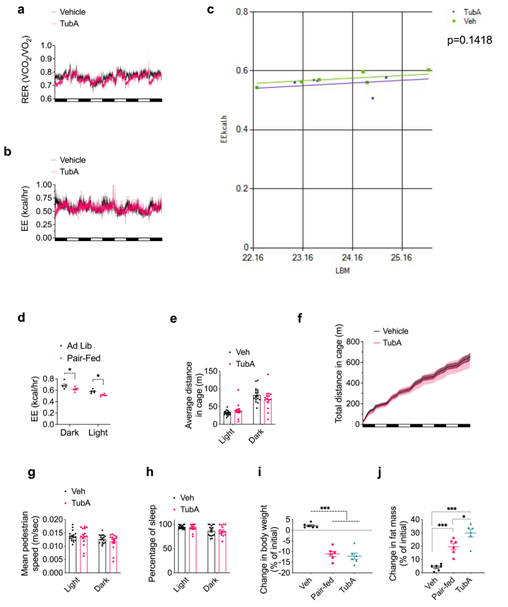
由于Tubastatin治疗后DIO小鼠脂肪质量减少,研究人员推测抑制HDAC6酶活性后增加了DIO小鼠对脂的利用。于是研究人员将DIO小鼠置于代谢笼中进行Tubastatin治疗,发现Tubastatin显著降低了DIO小鼠的进食量和体重,且呼吸熵也有所降低,表明Tubastatin促使DIO小鼠优先利用脂肪酸作为能量来源(Fig.3i-3k and Extended Data Fig. 4a)。虽然Tubastatin降低了DIO小鼠的摄食量,但能量消耗并没有发生变化 (Fig. 3i, 3l and Extended Data Fig. 4b,c),而研究人员单纯限制了DIO小鼠的摄食量后,发现DIO小鼠的能量消耗也相应下降(ExtendedData Fig. 4d),说明Tubastatin诱导的体重下降与单纯限制摄食量不同,Tubastatin降低了小鼠摄食量后并不会降低能量消耗。此外,Tubastatin治疗后DIO小鼠的运动参数和睡眠参数也没有发生明显变化(ExtendedData Fig. 4 e-h),表明Tubastatin不会影响小鼠的活动量以及昼夜节律。此外,与单纯限制摄食量小鼠相比,Tubastatin处理后DIO小鼠的体重和脂肪含量下降更多(ExtendedData Fig. 4i,j)。总之,这些结果表明Tubastatin处理不仅可促使肥胖小鼠对脂的利用从而降低体重,同时还显著改善了肥胖小鼠的代谢稳态。
拓展阅读
能量消耗与体重变化的关系
一般条件下,机体的能量代谢处于能量摄入和能量消耗的动态平衡中,以保持稳定的体重。当消耗的能量大于摄入的能量时,体重会呈下降趋势;反之,体重则会呈上升趋势,若能量摄入长期高于能量消耗,则会引起肥胖的发生。例如代谢研究中常见的肥胖小鼠造模方式,即给小鼠喂养含60%脂肪的高热量饲料,而小鼠的能量消耗远小于摄入的能量,从而引起小鼠体重的持续增加。近年来也有许多研究利用能量摄入和能量消耗的关系来治疗肥胖,如利用控制卡路里摄入的方式限制能量摄入,或促进小鼠白色脂肪棕色化增加能量消耗等治疗肥胖。本篇文章中,研究人员发现Tubastatin处理肥胖小鼠,降低了小鼠的摄食量,而并没有影响其能量消耗,从而显著降低肥胖小鼠的体重。
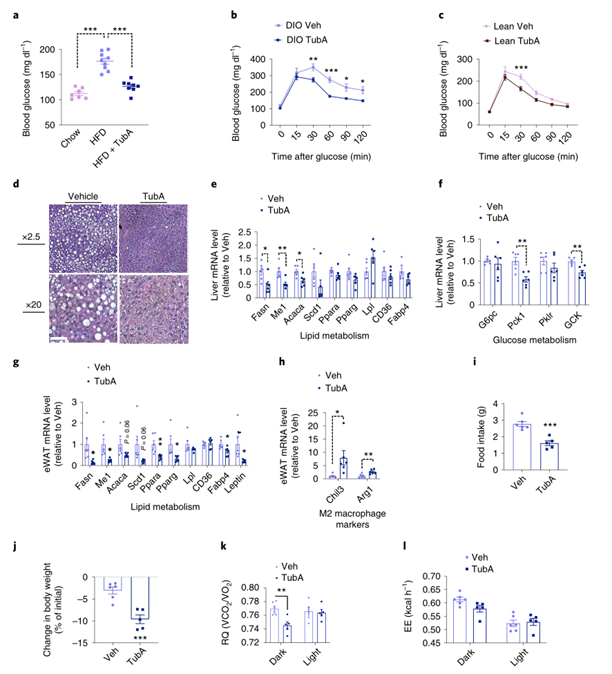
Fig.3 Tubastatin治疗改善 DIO 小鼠的代谢功能
3
3.Tubastatin需要瘦素信号转导发挥作用
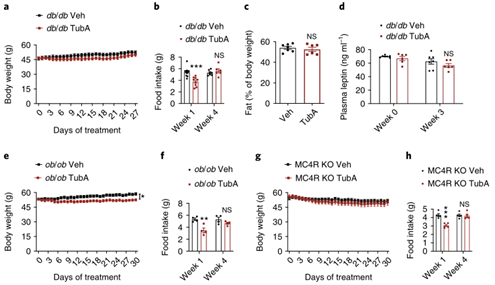
有研究表明,小鼠的体重和摄食量会受到脂肪抑制因子瘦素及其在中枢黑皮质素系统等回路中的活性调节,而瘦素、瘦素受体和黑皮质素受体4 (MC4R)的突变会引起小鼠和人类的过度摄食性肥胖。由于Tubastatin治疗可降低DIO鼠(高瘦素水平)的体重,但不影响正常饮食小鼠(正常瘦素水平)的体重,因此研究人员进一步探究了Tubastatin的减肥作用是否需要瘦素信号的介导。研究人员利用Tubastatin治疗db/db小鼠(瘦素受体缺失小鼠)4周后发现,db/db小鼠体重、摄食量、脂肪含量以及血液瘦素水平并没有发生显著变化(Fig.4a-4d)。此外,Tubastatin治疗也没有使ob/ob小鼠(瘦素缺失小鼠)和MC4R KO小鼠(黑皮质素受体4缺失小鼠)体重和摄食量发生较大变化(Fig.4e-4h),表明Tubastatin抑制HDAC6酶活性诱导肥胖小鼠体重下降的过程需要瘦素-黑皮质素系统的参与。随后研究人员检测了Tubastatin是否通过增强瘦素作用发挥功能。首先研究人员将正常饮食小鼠饥饿24h后给予瘦素(2.5mg/kg,该剂量的瘦素单独处理时不会引起小鼠体重变化)和Tubastatin治疗,并且再喂食,发现瘦素单独处理时减少了小鼠摄食量,但对体重无明显影响,Tubastatin单独处理虽然没有改变小鼠摄食量和体重,但和瘦素共同处理则进一步减少了小鼠摄食量并减少了小鼠体重(Fig. 5a, b),表明Tubastatin可增强外源性瘦素减弱食欲的作用。接下来,为了检测Tubastatin治疗是否可以增强ob/ob小鼠对外源性瘦素的敏感性,研究人员利用Tubastatin和低剂量瘦素(0.2 mg/kg,该剂量的瘦素单独处理时不会引起ob/ob小鼠的体重变化)处理ob/ob小鼠5天,发现瘦素和Tubastatin共同处理显著降低了ob/ob小鼠摄食量和体重,而瘦素或Tubastatin单独处理并没有发生显著改变(Fig.5c,d)。(小编注:ob小鼠缺乏内源性瘦素表达,所以对外源性瘦素的敏感性提高,因此需要更低剂量的瘦素处理,才能不引起ob小鼠体重的变化)
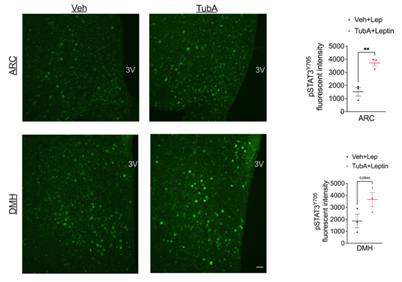
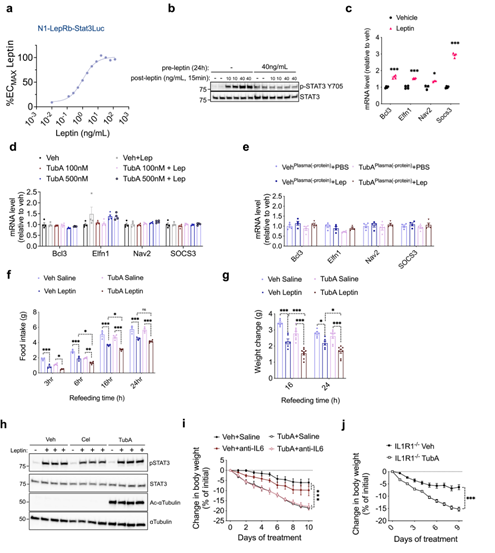
ob/ob小鼠由于缺乏瘦素而产生肥胖,然而DIO 小鼠血液中瘦素水平较高,但由于下丘脑对瘦素信号的敏感性下降,导致瘦素对食欲的抑制作用下降,从而产生瘦素抵抗,引起肥胖。因此研究人员想要探究Tubastatin治疗能否帮助DIO小鼠恢复瘦素敏感性。由于Tubastatin处理可以降低肥胖小鼠的体重,这可以增加中枢对瘦素的敏感性,因此研究人员首先检测了Tubastatin处理后DIO小鼠对外源性瘦素的敏感性。饥饿DIO小鼠24h后给予小鼠Tubastatin和瘦素处理,同时给小鼠再喂食,发现瘦素单独处理并没有显著改变DIO小鼠的体重和摄食量,Tubastatin单独处理显著降低了DIO小鼠体重和摄食量,而Tubastatin和瘦素共同处理则更进一步降低了DIO小鼠的体重和摄食量(Fig. 5e,f),此外研究人员还发现在Tubastatin治疗后,下丘脑中由瘦素诱导的STAT3磷酸化显著升高(ExtendedData Fig. 5)。这些结果表明Tubastatin处理可提高DIO小鼠中枢对瘦素的敏感性,从而降低体重和摄食量。
接下来,为了研究Tubastatin是否可以增强中枢对内源性瘦素的敏感性,研究人员在体外利用瘦素处理下丘脑N1-LRb细胞系后进行RNA-seq,筛选出了受瘦素调控的靶基因(SupplementaryTable 1),随后研究人员在正常饮食小鼠下丘脑中进行验证,确定这些基因在体内同样受到受体调控(Fig.5g),表明这些基因是瘦素信号转导的生理靶点。接着研究人员检测了由Tubastatin单独处理的DIO小鼠下丘脑中瘦素信号靶基因的表达变化,发现Tubastatin同样显著上调DIO小鼠下丘脑中瘦素靶基因(Fig.5h)。总之,这些结果表明Tubastatin可改善DIO小鼠的瘦素抵抗现象,从而缓解肥胖。
4.HDAC6 以细胞非自主的方式调节体重
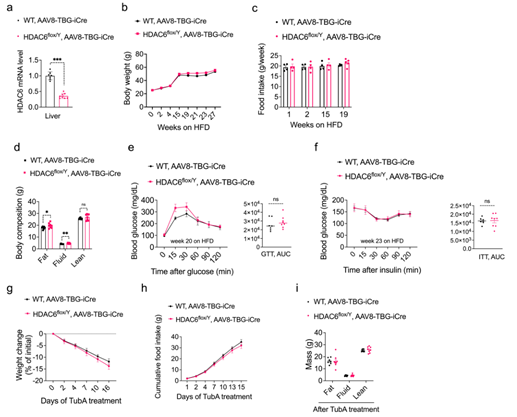
瘦素主要通过中枢系统对瘦素信号的转导来调节机体的能量平衡,因此为了探究Tubastatin是否直接作用于中枢系统来增加瘦素敏感性,研究人员首先向DIO小鼠侧脑室中注射足量的Tubastatin以抑制HDAC6活性,发现DIO小鼠的摄食量和体重并没有显著变化(Fig. 6a,b, Extended Data Fig. 6a),这表明Tubastatin并非直接作用于中枢系统来诱导DIO小鼠的体重减轻。因此研究人员推测Tubastatin提高中枢对瘦素的敏感性可能还需要其他外周组织的参与。随后研究人员向DIO小鼠腹腔注射Tubastatin,质谱分析发现Tubastatin主要在脂肪组织和肝脏中积累,血清和其他外周组织以及大脑中Tubastatin含量则较少(Fig. 6c),此外,研究人员还发现经Tubastatin处理后,DIO小鼠的iWAT、eWAT和BAT中HDAC6酶活性显著下降(Fig. 6d),但在脾脏、肾脏和肌肉中只略有下降,而肝脏和下丘脑中则没有变化(Extended DataFig. 6b,c),表明Tubastatin主要靶向抑制脂肪组织中HDAC6的活性。
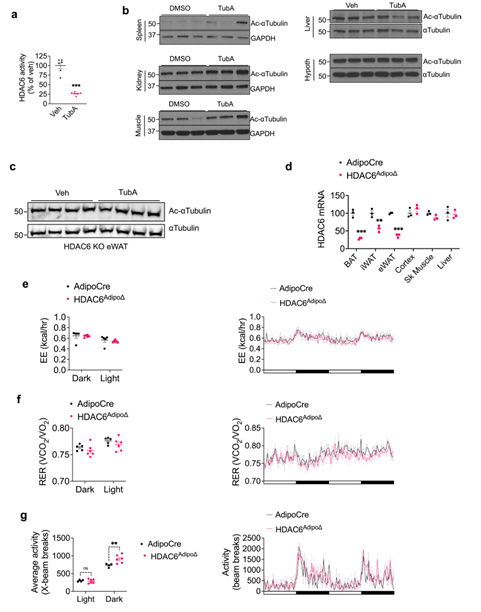
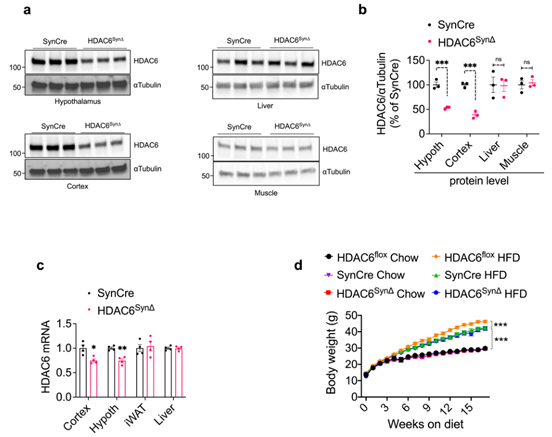
为了探索Tubastatin的具体作用位点,研究人员构建了HDAC6Adipo∆(脂肪特异性敲除HDAC6小鼠)小鼠和HDAC6Syn∆(神经元特异性敲除HDAC6)小鼠,发现在正常饮食HDAC6Adipo∆小鼠体重并没有明显变化,而在HFD饮食下的HDAC6Adipo∆小鼠虽然能量消耗和呼吸熵没有变化,但夜间活动量显著增加,且体重和脂肪含量显著降低,糖稳态也明显改善(Fig. 6e-g,Extended Data Fig. 6e-g),这和Tubastatin处理的DIO小鼠表型基本一致。随后研究人员利用Tubastatin治疗WT小鼠和HDAC6Adipo∆小鼠5周,发现WT小鼠在Tubastatin治疗后体重和摄食量显著下降,而HDAC6Adipo∆小鼠体重仅略有下降,摄食量并没有明显变化(Fig. 6h,i),说明Tubastatin的减肥作用在HDAC6Adipo∆小鼠中大大减弱。此外,研究人员发现无论在正常饮食还是HFD下HDAC6Syn∆小鼠与WT小鼠相比体重均无明显变化,并且利用Tubastatin治疗HFD喂养的HDAC6Syn∆小鼠后,HDAC6Syn∆小鼠与WT小鼠的体重下降程度也相同(Fig. 6j,Extended Data Fig. 7d),而利用AAV-Cre构建肝脏特异性敲除HDAC6基因小鼠,并给予Tubastatin处理,发现小鼠的体重和摄食量下降程度也没有出现显著差异(Extended DataFig. 8g,h)。这些结果表明Tubastatin可能是通过抑制脂肪组织而不是神经元和肝脏中的HDAC6酶活性来缓解肥胖的。然而,在HFD喂养下肝脏特异性缺失HDAC6的小鼠脂肪含量增加(Extended DataFig. 8d),这也在一定程度上解释了HFD喂养下HDAC6 KO小鼠发生肥胖的原因(Extended DataFig 2a)。
为了进一步阐明Tubastatin减轻肥胖的分子机制,研究人员对Tubastatin处理的WT小鼠,HDAC6 KO DIO小鼠以及HDAC6Adipo∆小鼠的eWAT进行RNA测序,发现Tubastatin处理后,WT DIO小鼠eWAT中有739个差异表达基因,其中只有57个(<8%)在Tubastatin处理的HDAC6 KO小鼠中发生了改变。而这57个差异表达基因中,有28个基因的表达在HDAC6Adipo∆和全身HDAC6 KO小鼠中都发生了改变,这表明Tubastatin能以依赖或不依赖HDAC6的两种方式发挥功能,但主要是以依赖HDAC6的方式发挥作用。此外,敲除HDAC6几乎没有引起其他HDAC家族成员的代偿反应,且HDACs在HDAC6Adipo∆和Tubastatin处理的WT DIO小鼠中的表达均没有显著变化(SupplementaryTable 2,3,4,5)。
以上结果表明,Tubastatin可能以一种细胞非自主方式增加中枢对瘦素的敏感性并减轻体重。为了证明这一结论,研究人员设计了一个体外瘦素敏感性实验,发现下丘脑N1-LRb细胞系对瘦素的敏感性具有剂量依赖性(Extended DataFig. 9a),并且用瘦素预孵育N1-LRb细胞可以再现由瘦素诱导的瘦素抵抗现象(Extended DataFig. 9b)。为了避免内源瘦素的潜在影响,研究人员利用Tubastatin或PBS处理ob/ob小鼠后,使用其血液和外源瘦素共同处理N1-LRb细胞,并检测瘦素靶基因的表达,发现经Tubastatin处理后,小鼠的血液能显著增强瘦素的作用效果(Fig. 6k,Extended Data Fig. 9c)。而单独使用Tubastatin(100nM和500nM,该浓度为Tubastatin处理的ob/ob小鼠血液中可检测到Tubastatin的浓度范围)和瘦素处理N1-LRb细胞,发现瘦素靶基因的表达并没有差异(ExtendedData Fig. 9d),说明并不是Tubastatin促进N1-LRb细胞对瘦素的敏感性增加,可能是小鼠在Tubastatin处理后,血液中产生了其他效应因子发挥作用。随后研究人员利用蛋白酶K和热激将血液中的蛋白质失活后再与瘦素共同处理N1-LRb细胞,发现瘦素靶基因的表达不再有明显差异(ExtendedData Fig. 9e),这再次证明了血液中介导瘦素增敏的效应因子并不是Tubastatin。并且研究人员发现Tubastatin处理后HDAC6Adipo∆小鼠的体重和摄食量并没有明显变化(Fig.6l, Extended Data Fig. 9f,g),这表明Tubastatin处理诱导的效应因子是由脂肪组织衍生的(Fig.6m)。
有研究发现胰淀素(Amylin)、GLP-1和雷公藤红素可通过 IL1R1和IL6信号促进瘦素的厌食作用,而Tubastatin并不能直接增强下丘脑N1-LRb细胞中的瘦素信号(ExtendedData Fig. 9h),因此研究人员想要看Tubastatin是否通过IL1R1或IL6信号来发挥减肥功能,发现利用IL-6中和抗体处理或敲除IL1R1基因并不影响Tubastatin诱导的DIO小鼠体重下降现象(Extended Data Fig. 9i,j),此外Tubastatin也不影响荧光标记的瘦素(Cy3-leptin)穿过血脑屏障(Fig.7a)。而向正常饮食小鼠的脑室中注射瘦素后,Tubastatin可显著降低小鼠的体重和摄食量(Fig.7b,c)。总之,这些结果表明Tubastatin诱导体重下降具有双重作用模式(小编注:第一重是Tubastatin直接作用于脂肪组织,靶向抑制脂肪中HDAC6酶活性;第二重是指间接作用于中枢神经系统,即Tubastatin作用于脂肪组之后,脂肪分泌出一种效应因子,作用于中枢从而提高中枢对瘦素的敏感性),即Tubastatin靶向抑制脂肪组织HDAC6酶活性,使脂肪组织分泌一种未知的效应因子,反向作用于中枢神经系统以提高中枢对瘦素敏感性(Fig. 6m)。
HDAC6是一种锌依赖性酶,其强效抑制剂(包括Tubastatin)都含有异羟肟酸残基作为锌的螯合部分(Fig.8a)。尽管有研究表明HDAC6特异性抑制剂比pan-HDAC抑制剂更安全,然而异羟肟酸残基的潜在副作用依旧阻碍着HDAC6抑制剂的临床应用。在此,研究人员发现了一种不含有羟肟酸结构的HDAC6特异性抑制剂SE7552,它与Tubastatin的结构并不相似,但对HDAC6的敏感性是其他已知HDAC同工酶的1000倍左右 (Fig. 8a-d),并且SE7552处理可以有效降低肥胖小鼠的体重(Fig. 8e),这为开发出可安全有效减肥的非羟肟酸HDAC6抑制剂提供了理论基础。然而SE7552不能诱导db/db小鼠的体重下降(Fig. 8f),这进一步表明了HDAC6抑制剂诱导的体重减轻需要完整的瘦素信号介导。
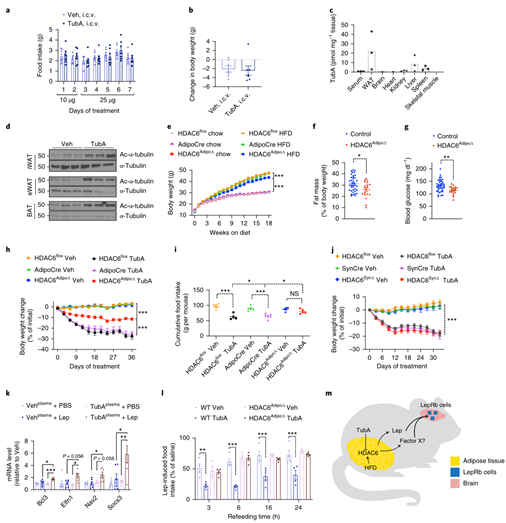
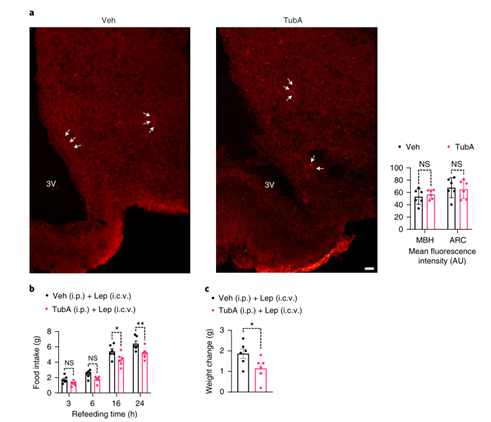
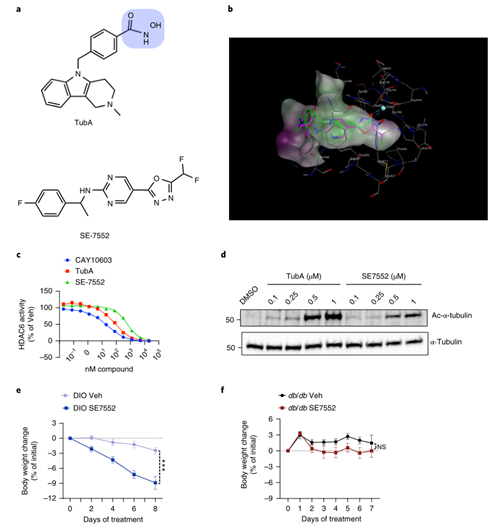
Fig.8 非羟肟酸HDAC6抑制剂可降低DIO小鼠体重
Extended Data Fig.9 HDAC6抑制剂的减肥作用需要一种未知的效应因子介导
总结
总而言之,本研究发现抑制HDAC6酶活性可通过提高肥胖小鼠中枢对瘦素的敏感性,而降低小鼠的体重、体脂以及摄食量,从而改善小鼠的代谢稳态。而HDAC6抑制剂(Tubastatin)并非直接作用于中枢系统,而是靶向抑制脂肪组织HDAC6酶活性,促使脂肪组织分泌一种效应因子,作用于下丘脑中瘦素-黑皮质素环路,通过调控瘦素下游信号通路(如脂类代谢),进而降低肥胖小鼠的食欲和体重。本研究结果为未来研发出可安全有效减肥的HDAC6抑制剂提供了理论基础。
原文链接:https://www.nature.com/articles/s42255-021-00515-3
关注微信公众号代谢学人
了解更多前沿资讯

转载本文请联系原作者获取授权,同时请注明本文来自徐凌燕科学网博客。
链接地址:https://blog.sciencenet.cn/blog-3483272-1330182.html
https://m.sciencenet.cn/blog-3483272-1331888.html
上一篇:代谢学人-- Hepatology近期NASH相关研究精选
下一篇:代谢学人--Nature Metabolism 2月刊代谢精选