博文
代谢学人--Nature:笑一笑十年少,冻一冻肿瘤少
||
代谢学人
Nature:笑一笑十年少,冻一冻肿瘤少
撰文 | 于柳 徐梓禾 陈俊桐 徐鑫铭 邱瑾
编辑 | 孟美瑶
校对 | 陈俊桐

背景介绍
代谢重编程是癌症的标志之一,癌细胞经常通过代谢重编程来促进其自身生长、增殖、迁移和存活。大多数癌细胞通常共有的一个显著特征是葡萄糖摄取增加,并产生乳酸。在有氧条件下,癌细胞能利用葡萄糖产生乳酸的途径生成 ATP来利用能量,即有氧糖酵解(又称Warburg 效应),是一种产生ATP的低效途径。与线粒体呼吸相比,Warburg 效应是癌细胞能量产生的默认途径,每分子葡萄糖通过有氧糖酵解仅产生两个 ATP 分子。然而,相对于健康细胞线粒体中葡萄糖完全氧化的速度,肿瘤细胞摄取葡萄糖的量使正常分化细胞的10倍,因此,肿瘤细胞中基于葡萄糖的有氧糖酵解速度加快了10-100 倍。事实上,超过 70% 的人类癌症显示出糖酵解基因表达增加。
高速率的有氧糖酵解导致癌细胞从肿瘤微环境(TME)中摄取更多的葡萄糖并产生大量的乳酸。葡萄糖摄取是有氧糖酵解的限速步骤,由癌细胞膜中的葡萄糖转运蛋白(GLUTs)介导。随着肿瘤的生长,导致肿瘤组织内缺氧,进而触发HIF-1α(缺氧诱导因子-1α)的表达,最终通过转录调控上调癌细胞中GLUT1的表达,促进葡萄糖的摄取。有氧糖酵解可提供大量的代谢物作为生物大分子合成的中间体,包括核苷酸底物核糖-5-磷酸和甘氨酸以及脂质底物甘油。细胞内乳酸的积累导致酸中毒,从而创造了有利于癌细胞生长的微环境。
BAT(棕色脂肪组织)是一种通过产生热量来消耗能量的特殊脂肪组织。冷刺激、饮食和药物触发的交感神经激活诱导了BAT激活和WAT(白色脂肪组织)转化为棕色样表型。因此,活化的BAT和褐变WAT通过NST(非震颤性产热)产生热量,并由线粒体内膜中表达的UCP1(解偶联蛋白1)介导。越来越多的证据表明,葡萄糖有助于 BAT 产热;且Glut1和Glut4或己糖激酶(糖酵解中的初始酶)基因的敲低,会显著损害新陈代谢。BAT介导的 NST 是一种有效的能量消耗机制,用于减轻肥胖和糖尿病动物的体重和改善代谢功能障碍。由于成年人体内存在大量 BAT 组织,因此推测激活 BAT 产热将为治疗肥胖症和 2 型糖尿病提供方法。
在本文中,作者表明,由冷暴露诱导的BAT活化显著抑制了各种实体瘤的生长速率,BAT去除和UCP1基因缺失恢复了冷暴露下的肿瘤生长速率。作者介绍了NST触发肿瘤抑制的机制,最后初步发现成年健康人类和癌症患者能通过轻度冷暴露激活BAT,冷暴露显著抑制了人类肿瘤的葡萄糖摄取。这为癌症治疗提供了一个概念,并将给予癌症患者实质性的临床益处。

敲黑板啦!
1、寒冷抑制肿瘤并延长生存
2、寒冷能够诱导BAT和皮下WAT褐变
3、寒冷促使肿瘤细胞代谢重编程
4、相较于肿瘤,在寒冷条件下BAT摄取较多葡萄糖
5、Ucp1 缺失可减轻冷暴露对肿瘤的抑制作用
6、人类癌症患者的 BAT 被激活,抑制肿瘤摄取葡萄糖
研究结果
恶性肿瘤被认为是一种代谢紊乱,大多数实体瘤通过加速糖酵解代谢(即 Warburg 效应)获得能量,促进其生长和迁移。然而,TME 和宿主宏观环境的改变通常会导致癌细胞的代谢重编程,特别是脂质代谢的激活,可能会大大重新编程癌症代谢途径,从而改变肿瘤生长速率、转移潜力和药物反应。为了研究脂肪组织中产热相关代谢对肿瘤生长和癌症宿主存活的影响,作者分析了冷驯化(已知可激活 BAT)对肿瘤生长和进展的影响。
皮下植入结直肠癌细胞(CRC)到免疫功能正常的C57BL / 6小鼠中,相对于30°C环境下的小鼠,在4°C下可显著抑制肿瘤生长(图1a)。然而,在正常小鼠饲养温度22°C下并未观察到抑制肿瘤的作用(扩展数据图1a)。低温停止后,冷暴露对肿瘤生长的抑制是可逆的(扩展数据图1b)。与这一观点相一致的是,在4°C下,处于G0 / G1期的肿瘤细胞亚群显著增加,而S和G2 / M期的细胞群减少(扩展数据图1c,d),因此在4°C条件下肿瘤细胞的增殖情况是被抑制的。为了进一步验证这些结果的普遍性,作者研究了其他癌症类型的寒冷诱导的肿瘤抑制情况,包括纤维肉瘤,乳腺癌,黑色素瘤和胰腺导管腺癌。同样,携带肿瘤的小鼠的冷暴露也显著地抑制了这些肿瘤类型的生长速率(扩展数据图1e-h)。表明冷暴露可以显著抑制小鼠各种类型肿瘤的生长速率。同样的,在4°C条件下, CRC肿瘤携带小鼠的存活率显著延长(图1b)。与30°C的热中性条件相比,4°C肿瘤小鼠的总生存期几乎翻了1倍。除了冷暴露外,作者还使用β3-肾上腺素受体激动剂CL-316,243处理CRC肿瘤携带小鼠。结果显示,CL-316,243也显著抑制了体内肿瘤生长和肿瘤细胞增殖(扩展数据图1i-k),进一步验证了作者的发现。
为了研究肿瘤微环境(TME) 在 30°C 热中性和 4°C 冷暴露条件下的变化,作者使用多种标记物进行了免疫组织化学分析,以检测各种细胞成分。作者发现,冷暴露改善了 CRC 肿瘤的缺氧情况(图 1c,d)。尽管冷和热中性组的肿瘤大小大致相等(小编注:本研究中,作者将冷暴露下异种移植荷瘤小鼠实验持续时间延长,以使肿瘤达到与热中性组肿瘤达到相同的大小。),但在冷适应下 CD31标记的肿瘤微血管的密度显著降低(图 1c,d)。重要的是,Ki-67 阳性的肿瘤细胞增殖率在冷暴露条件下也被显著抑制。此外,相对于 30°C 条件下的肿瘤,冷暴露的 CRC 肿瘤中的 CD45标记的骨髓细胞群减少(扩展数据图 1l,m)。相比之下,肿瘤相关巨噬细胞(IBA1+) 和癌症相关成纤维细胞(FSP1+)的数量保持不变,骨髓细胞、肿瘤相关巨噬细胞和癌症相关成纤维细胞均为TME中的重要细胞群,该结果说明4°C 冷暴露并不影响这些细胞群的组成(扩展数据图 1l,m)。且未观察到细胞凋亡的变化(图1c,d)。冷暴露的纤维肉瘤、乳腺癌、黑色素瘤和胰腺癌的免疫组织化学分析也得到了相同的结果(扩展数据图 1n-q 和 2a-g),说明冷暴露改善了各种实体瘤的缺氧情况,改变了TME,进而可能抑制了肿瘤生长。
为了进一步证实这些发现,作者选用两种遗传自发肿瘤模型用于冷暴露研究。在 MMTV-PyMT 乳腺癌模型中,小鼠(10 周龄)暴露于 4°C ,能显著抑制肿瘤生长(图 1e)。与异种移植肿瘤相似,自发性 MMTV-PyMT 肿瘤细胞在冷暴露下的增殖率低于热中性(扩展数据图 2h,i)。同时,在冷暴露条件下,CD31 血管结构减少且肿瘤缺氧情况也被抑制(扩展数据图 2h,i)。此外,在自发的 ApcMin/肠腺瘤模型中,冷暴露同样也抑制了肿瘤的生长(图 1f)。与 MMTV 乳腺癌相似,冷暴露也抑制了其他肿瘤细胞增殖、肿瘤缺氧和血管生成(扩展数据图 2j,k)。总之,这些结果表明冷暴露显著抑制肿瘤生长并改变 TME。
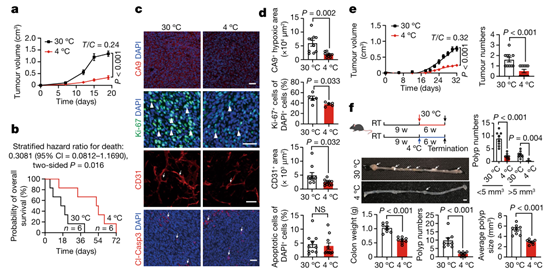
图1. 冷暴露抑制异种移植和基因自发肿瘤生长,延长荷瘤小鼠的总体生存期并改变TME
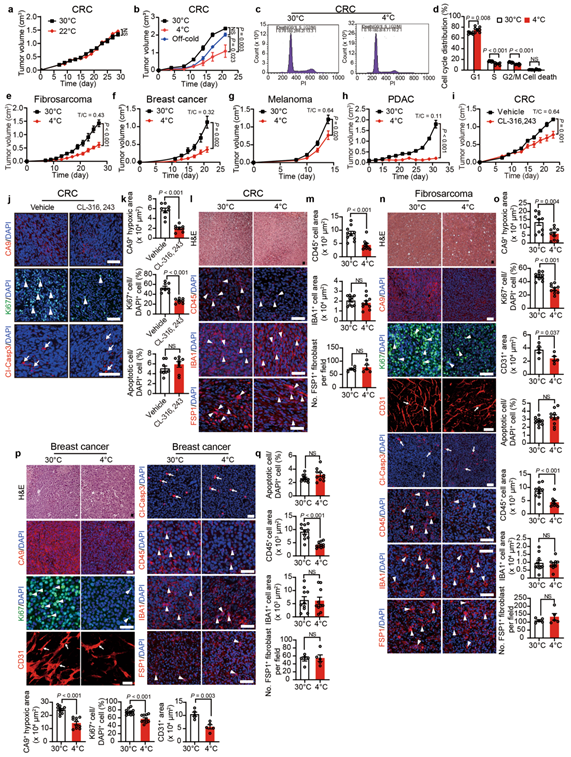
附图1.冷暴露对肿瘤微环境的改变
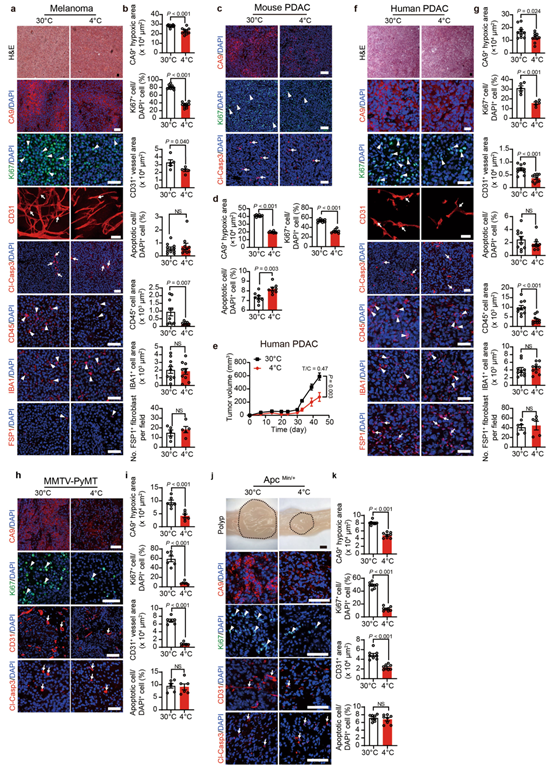
附图2. 冷诱导各种肿瘤模型肿瘤微环境的变化
2
2.冷暴露抑制肝脏肿瘤
在皮下肿瘤模型中,冷暴露有可能通过降低皮下位置的局部温度来抑制肿瘤生长。虽然自发性ApcMin/+肠腺瘤模型在很大程度上排除了这种可能性,但为了进一步确保实验结论的可信度,作者将肿瘤植入内脏器官来验证上述的结论。作者之所以选择肝脏作为肿瘤细胞植入部位,是由于CRC容易转移到肝脏组织,因此能够更好的研究肿瘤的生长情况。与皮下肿瘤模型类似,将小鼠CRC植入肝脏后,冷暴露能够显著抑制肿瘤生长(扩展数据图3a)。同样,在免疫缺陷小鼠中植入人CRC也重复了肝脏组织中冷触发的肿瘤抑制作用(扩展数据图3b)。这些结果排除了寒冷诱导的肿瘤抑制中,皮肤接触低温对肿瘤产生直接影响的可能性。
同样的,小鼠和人类 CRC 肿瘤组织的免疫组织化学分析结果验证了皮下异种移植和遗传肿瘤模型中冷暴露抑制肿瘤生长的结论,包括改善肿瘤缺氧、减少 CD31 微血管、减少肿瘤细胞增殖和CD45细胞数量(扩展数据图 3c-f)。
为了进一步排除低温接触对肿瘤抑制的影响,作者还测量了荷瘤小鼠不同位置的体温。与 30°C 条件下相比,在 4°C 暴露条件下,小鼠肛门内测得的CBT (核心体温) 升高(扩展数据图 3g)。但将探针插入小鼠皮下区域未检测到任何体温差异(扩展数据图 3g)。此外,在 4°C 和 30°C 暴露的荷瘤小鼠之间,肿瘤组织的温度保持不变(扩展数据图 3h)。同样,器官内肿瘤移植模型中的 CBT 和皮下温度在热中性和寒冷条件下几乎相同(扩展数据图 3i)。这些数据进一步排除了直接接触低温影响延迟肿瘤生长速率的可能性。
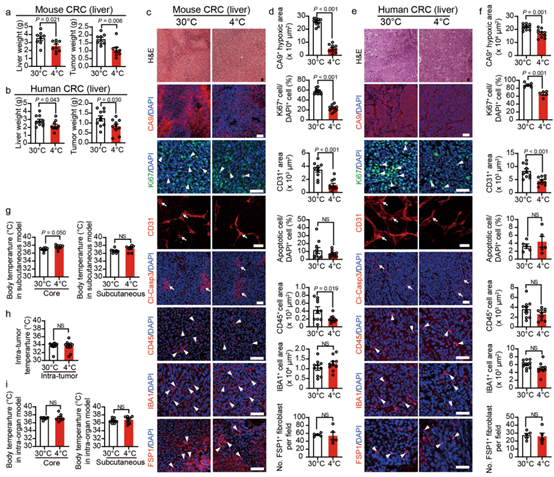
附图3. 冷暴露抑制肝脏肿瘤模式下的肿瘤生长
拓展阅读
APC Min/+小鼠自发性结直肠癌模型
APC Min/+小鼠模型是利用突变的APC基因产物,来导致肠道上皮细胞质β-catenin蛋白的积累,其入核后与TCF4/LEF转录因子结合启动下游基因CyclinD 1等原癌基因的活化表达。
具体分子机制:APC基因编码的蛋白是一种肿瘤抑制蛋白,可作为Wnt信号传导途径的拮抗剂。当APC蛋白表达缺失或降低时,可能会导致β-catenin免于降解,使游离的β-catenin在胞浆内聚集并进入核内,激活相关靶癌基因,导致细胞癌变的发生。此外,APC蛋白还涉及其他生物调节过程,包括细胞迁移和粘附,转录激活和细胞凋亡。而APC Min/+突变小鼠特指APC基因第850位氨基酸从Leu突变成终止密码子,造成无义突变。
APC Min/+小鼠品系采用基因编辑技术制作,该品系纯合子不能存活。高脂饮食条件下,雄性和雌性杂合小鼠有明显的肠道腺瘤且数量较多,多见于回肠和空肠。因此APC Min/+小鼠模型是理想的肠道肿瘤模型。在本文中作者利用该遗传自发性肿瘤模型的小鼠进一步验证了寒冷有利于抑制肿瘤的生长。
参考文献:
[1]Moser, A. R.et al European journal of cancer (Oxford, England : 1990), 31A(7-8), 1061–1064.
3
为了研究冷暴露是否可以激活荷瘤小鼠的BAT,作者将无肿瘤和荷瘤的小鼠暴露于4°C和30°C。与无肿瘤小鼠类似,与30°C相比,4°C条件下异种移植肿瘤和遗传自发携带肿瘤的小鼠的BAT均表现出高度致密的结构,其表现为较小的多房结构(图2a和扩展数据图4a-c),这是BAT激活的典型形态。与表型改变相一致,在冷适应条件下,BAT的线粒体COX4(细胞色素c氧化酶亚基4)含量和CD31微血管密度显著增加(图2a和扩展数据图4a-c)。同样的,与在无肿瘤小鼠中观察到一致,与30°C相比,4°C条件下,UCP1(一种关键的产热蛋白)的表达水平在肿瘤携带小鼠BAT中增加(图2a和扩展数据图4a-c)。这些发现表明,将肿瘤植入小鼠体内并没有显著影响冷诱导的BAT激活。
众所周知,冷暴露也会激活 WAT并表现出褐变表型,尤其是皮下 WAT (sWAT)。冷暴露条件下的sWAT的组织学和免疫组织化学结果显示出典型的褐变表型,表现为较小的脂肪细胞、细胞内多房结构的富集、线粒体含量高、微血管数量增加以及异种移植和自发肿瘤模型中 UCP1 表达升高的状态(扩展数据图 4d –g)。这些数据表明肿瘤不会干扰 sWAT 褐变。
接下来,作者使用PET-CT (正电子发射断层扫描 - 计算机断层扫描) 成像分析,测量18F-FDG (18F-氟脱氧葡萄糖) 在荷瘤小鼠的各个器官中的摄取情况。在热中性条件下,18F-FDG 分布主要积聚在肿瘤组织中,在异种移植和自发肿瘤模型的 BAT 中发现比较微弱的信号(图 2b-d)。然而,在冷暴露组和热中性组的肿瘤大小大致相等的情况下,冷暴露显著促进了iBAT (肩胛间 BAT) 中的 18F-FDG 分布,而 18F-FDG 信号在肿瘤中几乎无法检测到(图 2b-d)。定量分析进一步支持了冷诱导 18F-FDG 在 iBAT 和肿瘤之间重新分布的结论(图 2b-d)。这些发现表明,冷暴露确实通过促进 BAT 葡萄糖摄取来减少肿瘤中的葡萄糖摄取,从而抑制肿瘤生长。
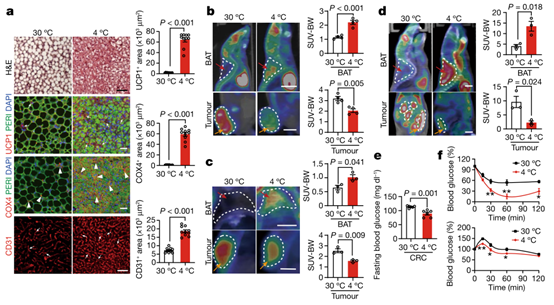
图2. 脂肪组织和肿瘤中的脂肪活化和葡萄糖摄取
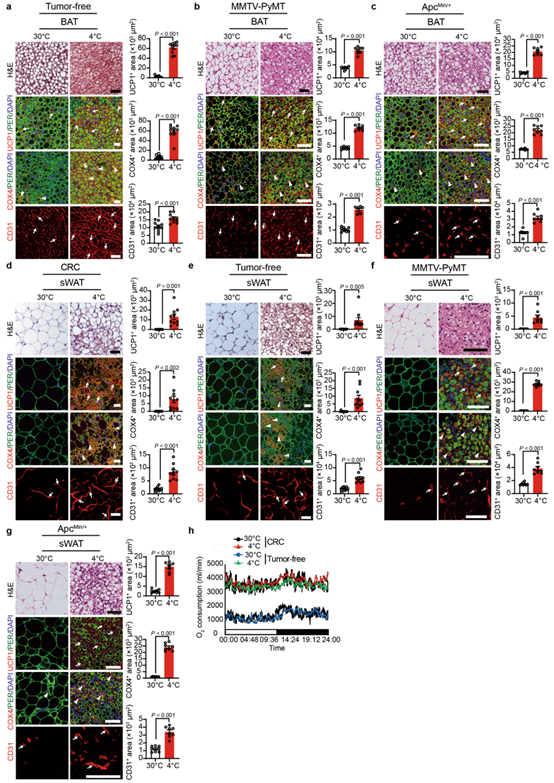
附图4. 异种移植和遗传自发肿瘤模型中冷暴露导致脂肪组织褐变
4
4.BAT依赖的肿瘤抑制作用
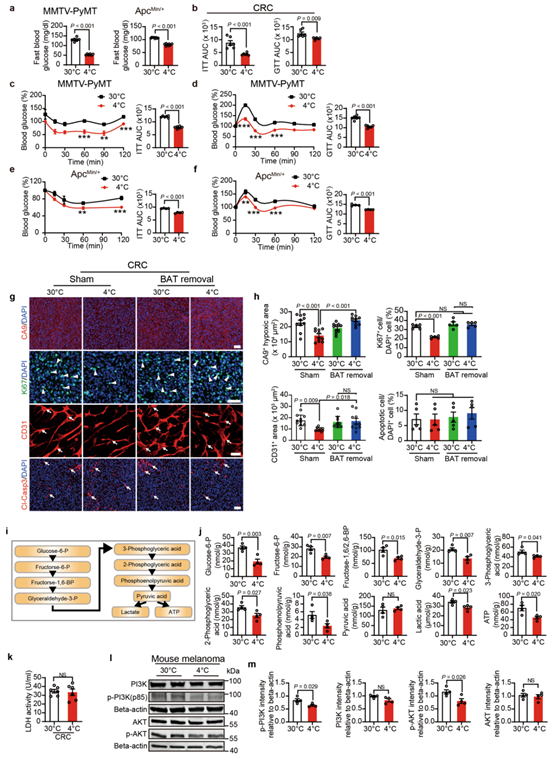
众所周知,冷暴露会增加小鼠的产热。为了研究冷暴露下的代谢变化,作者检测了荷瘤小鼠的产热情况。在 4°C 和 30°C 组荷瘤小鼠的肿瘤大小相似的情况下,相对于热中性组,冷暴露增加了 CRC 肿瘤小鼠的代谢速率(扩展数据图 4h)。值得注意的是,在异种移植和自发性小鼠肿瘤模型中,冷暴露处理组的空腹血糖水平明显降低(图 2e 和扩展数据图 5a)。同时,胰岛素耐受性和葡萄糖耐受性测试结果显示,肿瘤小鼠在冷暴露下的胰岛素敏感性和葡萄糖清除率显著改善(图 2f 和扩展数据图 5b-f)。这些实验表明,冷暴露显著降低了荷瘤小鼠的血糖水平并提高了胰岛素敏感性。
为了确定BAT激活在肿瘤抑制中的作用,作者接下来通过对携带肿瘤的小鼠进行手术去除BAT后,检测肿瘤代谢。有趣的是,在4°C下,去除BAT后的荷瘤小鼠的血糖水平显著增加(图3a),该结果表明小鼠BAT的激活是降低血糖的主要原因。重要的是,BAT的切除几乎完全消除了冷诱导的肿瘤抑制效果(图3b)。相比之下,BAT切除对热中性条件下的肿瘤生长没有影响(图3b)。因此,BAT的激活是冷触发的肿瘤抑制的主要原因。BAT切除还明显地促进了肿瘤缺氧,血管生成和肿瘤细胞增殖(扩展数据图5g,h)。因此,在冷暴露的荷瘤小鼠中去除BAT也改变了TME,利于肿瘤生长。
除了异种移植 CRC 肿瘤模型外,作者还在自发遗传 MMTV-PyMT 乳腺癌荷瘤小鼠中去除了 BAT。与上述结果相一致,去除 BAT 完全消除了冷诱导的肿瘤抑制(图 3c)。并且,在相同的肿瘤大小下,通过去除 BAT 完全中和了乳腺癌中冷减轻的 18F-FDG 摄取,恢复了与 30°C 暴露组相同的肿瘤细胞葡萄糖摄取状态(图 3d)。同时,去除BAT也消除了冷诱导下肿瘤缺氧、血管生成和肿瘤细胞增殖减少等情况(图 3e,f)。因此,这些数据证明了肿瘤抑制的BAT依赖性机制。
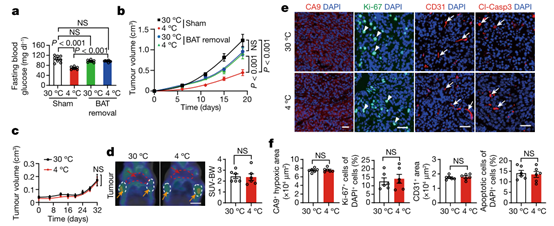
图3. 切除BAT可消除冷触发的肿瘤抑制
附图5. 去除BAT可消除冷暴露肿瘤中的肿瘤微环境变化和缓解PI3K激活
拓展阅读
MMTV-PyMT 乳腺癌模型
MMTV-PyMT 乳腺癌模型是乳腺癌原发瘤模型中一类基因工程乳腺癌小鼠模型,其制作原理是利用乳腺特异性启动子MMTV-LTR定向高表达癌基因PyMT,进而诱发乳腺癌。
具体的机制:若要建立该转基因小鼠模型,首先要构建重组质粒,将编码The polyomavirus middle T antigen(PYMT)的cDNA片段插入来源于pMMTV neuNT的MMTV - LTR中,然后再接入来源于CDM8的SV40 poly A,最后将构建好的片段插入 Bluescript KS载体中从Sal I到 Hind III的位置中,确认该质粒具有生物学活性以后,用显微注射的方式将质粒注射到小鼠的受精卵中,再植入母鼠体内,经过筛选后最终得到MMTV-PyMT小鼠模型。
MMTV-PyMT小鼠的特点是最早在第8周开始发病,第9周开始出现可触及的肿瘤,大部分在第11周出现肺转移,第14周达到晚期乳腺癌水平,最长生存期可达15周。目前该转基因小鼠模型已经成功保种和扩群,可稳定自发乳腺癌,其生物学特性和病理学改变与人源乳腺癌相近,因而可以作为乳腺癌发生发展的经典动物模型。
参考文献:
[1]Shanzer, M.et al.Oncogene, 34(32), 4190–4198.https://doi.org/10.1038/onc.2014.347
5
去除BAT可以消除寒冷诱导的肿瘤抑制作用,这些结果表明,寒冷条件下BAT的激活可能会改变肿瘤代谢。为了探究这种可能性,作者使用了两种经典的基因组和蛋白质组学方法。通过RNA-seq(RNA测序)进行的GSEA(基因集富集分析)结果显示,冷暴露的CRC肿瘤小鼠的肿瘤中,糖酵解和脂质代谢明显减弱(图4a)。同时,详细的代谢组学分析显示,冷暴露的CRC肿瘤小鼠BAT中糖酵解显著增加(图4b和扩展数据图5i)。糖酵解途径的几个关键组分,包括葡萄糖1-磷酸,葡萄糖6-磷酸,果糖1,6-二磷酸,甘油醛-3-磷酸,3-磷酸甘油酸,2-磷酸甘油酸,磷酸烯醇丙酸,丙酮酸和乳酸盐,均显著增加(图4b)。相比之下,这些关键的糖酵解中间物在冷暴露的肿瘤中明显降低(图4c和扩展数据图5j)。作者分析冷暴露是否可能通过减轻LDH(乳酸脱氢酶)活性导致乳酸产生减少,为了排除这一可能性,作者在4°C和30°C条件下测量了CRC肿瘤的LDH活性。结果表明,乳酸脱氢酶活性在冷暴露下没有改变(扩展数据图5k)。
值得注意的是,在冷暴露荷瘤小鼠的肿瘤中,包括Glut1,Glut4和Glut7的GLUT水平均显著降低(图4d)。相比之下,在冷暴露下,BAT中Glut4和糖酵解相关基因显著升高(图4d)。与肿瘤糖酵解的抑制一致,CRC肿瘤中PI3K(磷脂酰肌醇-3-激酶),AKT和mTOR(哺乳动物雷帕霉素)的活化在冷暴露下也被显著抑制(图4e,f)。在冷暴露的黑色素瘤中也发现了类似的PI3K活化抑制(扩展数据图5l,m)。这些数据表明,冷暴露通过抑制糖酵解途径诱导肿瘤中的代谢重编程,抑制肿瘤组织能量的产生,从而抑制了肿瘤的生长。
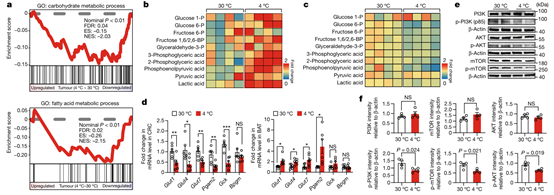
图4. 糖酵解代谢组学分析和PI3K信号的检测
拓展阅读
mTOR信号通路
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)是一种非典型丝氨酸/苏氨酸蛋白激酶,为磷脂酰肌醇激酶相关激酶蛋白质家族成员。mTOR进化上相对保守,可整合营养、能量及生长因子等多种细胞外信号,在细胞增殖、各类物质合成代谢以及细胞的凋亡与自噬等生理过程中发挥核心作用。 细胞内存在mTORC1和mTORC2两种不同的复合体,它们接受着不同信号分子的调控,从而发挥不同的作用。mTORC1主要受生长因子、能量状态、含氧量和氨基酸等多种信号的调节,可以通过磷酸化两个关键效应子—p70核糖体S6激酶 (S6K) 和真核起始因子eIF4E的结合蛋白4EBP来促进下游蛋白质合成。此外它还可以促进缺氧诱导因子-1(HIF1α)的翻译驱动几种糖酵解酶的表达,同时还可以通过下游的固醇调节元件蛋白(SREBP)促进NADPH及其他中间代谢物的生成以促进葡萄糖代谢过程,最终利于细胞增殖和生长。而mTORC2主要充当胰岛素/ PI3K信号传导的效应子,通过下游关键效应物Akt磷酸化和抑制几种关键底物,如FoxO1/3a转录因子、GSK3b和TSC2,最终促进细胞存活、增殖和生长。
总之,在肿瘤发生时,促肿瘤形成的蛋白PI3K和Akt过度表达, 使mTOR信号通路持续激活,从而参与肿瘤的发生发展。本文中作者通过检测到寒冷抑制PI3K、AKT、mTOR信号通路的激活证明了冷暴露通过抑制糖酵解途径诱导肿瘤中的代谢重编程过程。
[1] Saxton, R. A., & Sabatini, D. M. (2017). mTOR Signaling in Growth, Metabolism, and Disease. Cell, 169(2), 361–371.
GLUT的分类与调控
葡萄糖作为生物体主要燃料、多功能生物前体和信号分子,通过各种机制严格控制着代谢稳态(例如胰岛素和胰高血糖素的激素调节)。负责这些葡萄糖进出组织器官的关键门控蛋白之一就是葡萄糖转运体(GLUT)。GLUT是一类调控细胞外葡萄糖进入细胞内的跨膜蛋白家族,参与糖代谢、炎性反应和免疫应答等过程,能供给组织器官能量并且调节机体葡萄糖水平稳态。因此,某些特定GLUT的膜转运或功能受损是机体葡萄糖水平紊乱、高血糖和糖尿病产生的重要原因。
GLUT共有六种,分别命名为GLUT1、GLUT2、GLUT3、GLUT4、GLUT5、GLUT7。各组织的GLUT分布各不相同,GLUT1的分布最为广泛,在许多胚胎和成年组织细胞中均有表达。GLUT2主要表达于肝细胞、胰腺β细胞、小肠粘膜细胞和肾小管上皮细胞。GLUT3主要表达于成人脑神经元细胞。GLUT4则是脂肪细胞和骨骼肌细胞内最主要的葡萄糖转运蛋白。胰岛素调控的GLUT4膜转运对于机体血糖平衡的维持至关重要,因此GLUT4的转运障碍就是机体产生胰岛素抵抗或患有2型糖尿病的主要表现之一。GLUT5主要分布于小肠。GLUT7的分布情况目前还暂不清楚。
在机体中,血糖水平与缺血、缺氧经常同时影响GLUT的表达。大脑对缺血、缺氧最敏感,这个调控也主要发生在脑组织分布广泛的 GLUT1和GLUT3。在缺氧缺血的情况下,脑内能量代谢由有氧氧化转为无氧酵解,需要消耗大量的葡萄糖,GLUT 1和GLUT 3的增加即为适应这种变化,是机体出于自身生存需要的一种反应。此时,各部位的GLUT都会增加或用移位的方式以适应机体的能量供给。在心肌缺血时GLUT1和GLUT4均由细胞器膜向细胞质膜转位,使细胞质膜GLUT绝对数量增加,有益于更多的葡萄糖转运至细胞内,参与糖酵解,为心肌提供有限的 ATP ,有利于缺血后心肌保护。肿瘤的缺氧状态可通过缺氧诱导因子体现,有研究发现,在一系列人类肿瘤,包括结肠癌、乳腺癌、皮肤癌、卵巢癌、前列腺癌等肿瘤中,缺氧诱导因子α水平明显上调,从而介导缺氧反应基因的调控而上调GLUT的表达。在缺氧的肿瘤生长环境中,GLUT表达增加,可以使葡萄糖的摄取增加,使得远离间质血管的缺氧肿瘤细胞通过糖酵解产生 ATP 得以生存。因此,增加GLUT表达也是肿瘤缺氧的一种标志,GLUT可成为评估肿瘤恶性程度的标准之一。在本篇文献中,作者就通过测定各种GLUT水平来评估肿瘤的生长状态。
参考文献:
[1] 陈晓云,陈跃. 葡萄糖转运蛋白的调控与疾病. 2008
[2] Deng D, Yan N. GLUT, SGLT, and SWEET: Structural and mechanistic investigations of the glucose transporters. Protein Sci. 2016 .
6
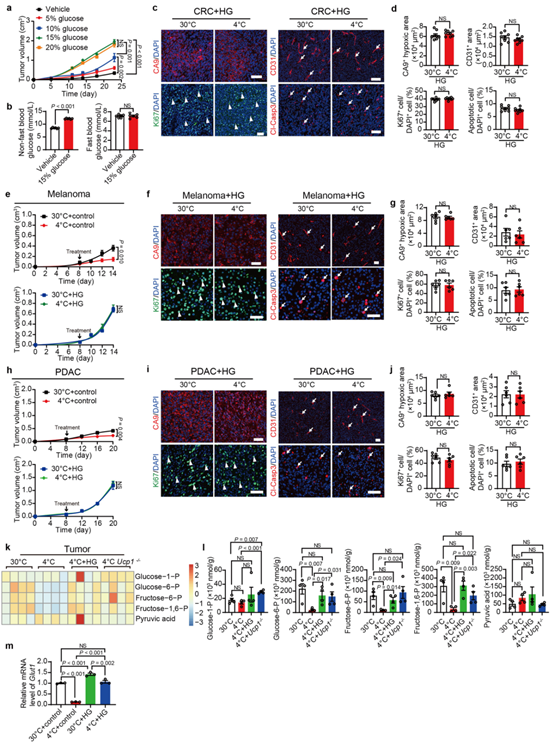
为了验证肿瘤和BAT的活化之间竞争葡萄糖的假设是否是寒冷诱导的肿瘤生长抑制的关键,作者采用了高糖喂养的荷瘤小鼠模型。结果显示,在热中性条件下,饮用水中葡萄糖浓度的升高导致小鼠肿瘤生长速率加快(扩展数据图6a)。饮用水中添加15%葡萄糖,能够达到肿瘤生长的最大促进作用。所以作者在后续的实验中使用了15%的葡萄糖。
在非禁食和热中性条件下,给小鼠喂食 15% 葡萄糖会增加血糖水平,即高血糖(扩展数据图 6b)。但用高葡萄糖喂养小鼠并不会诱发高血糖症(扩展数据图 6b)。有趣的是,用 15% 的葡萄糖喂养可消除冷暴露对CRC 肿瘤小鼠的肿瘤抑制作用(图 5a)。即用 15% 葡萄糖喂养时,30°C 和 4°C 组的肿瘤细胞增殖、肿瘤缺氧、微血管密度和炎症无差异(扩展数据图 6c、d)。同时,在黑色素瘤和胰腺导管腺癌小鼠模型中再现了在冷暴露下通过高糖喂养恢复肿瘤生长的情况(扩展数据图 6e-j)。与此一致地,代谢组学数据显示高葡萄糖喂养在冷暴露下很大程度上恢复了肿瘤糖酵解(扩展数据图6k,l)。这些发现表明,通过高糖喂养补偿血糖消除了寒冷诱导的肿瘤抑制,这表明活化的 BAT 中葡萄糖摄取增加是肿瘤抑制的重要机制。
为了进一步阐明高葡萄糖喂养恢复肿瘤生长的可能机制,作者分析了冷暴露下 CRC 肿瘤中 GLUT1 的表达情况。结果表明,高糖喂养将 4°C 小鼠肿瘤组织的葡萄糖摄取恢复到了与 30°C 高葡萄糖喂养组几乎一致的水平(图 5b)。冷暴露期间的 Glut1 mRNA 和蛋白质表达水平也因高葡萄糖喂养而升高(扩展数据图 6m)。值得注意的是,高葡萄糖喂养通过促进蛋白质磷酸化显著增强了 PI3K 和 AKT 的激活,以及冷暴露肿瘤中 GLUT1 的表达(图 5c)。这些数据表明高葡萄糖喂养通过 GLUT1 介导的途径恢复了肿瘤对葡萄糖的摄取。
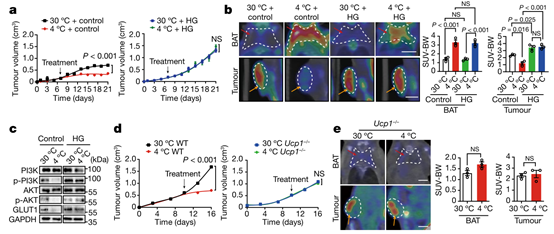
图5. 高糖喂养和UCP1缺乏可消除冷诱导的肿瘤抑制
附图6. 高糖喂养对糖酵解代谢和肿瘤微环境的影响
7
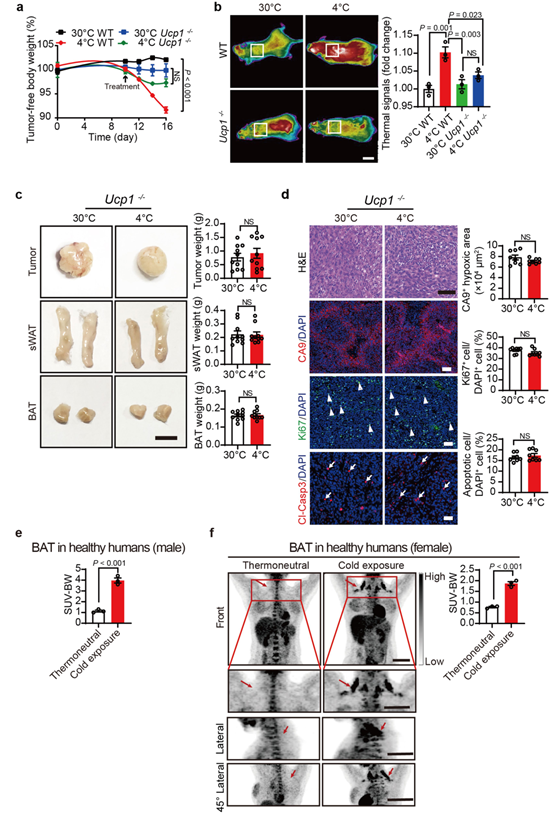
由于UCP1是负责脂肪组织中NST(非震颤性产热)的关键线粒体蛋白,因此作者在肿瘤实验中使用了Ucp1−/−小鼠模型。在野生型(WT)小鼠中,冷暴露显著降低了小鼠体重,而Ucp1基因的缺失则消除了这种效应(扩展数据图7a)。Ucp1的缺失消除了冷暴露的肿瘤抑制作用(图5d)。与此观察结果一致的是,UCP1缺失显著减少了冷适应环境下的热量产生(扩展数据图7b)。PET-CT 扫描分析显示冷暴露与热中性温度下的Ucp1-/- 小鼠 BAT 中的葡萄糖摄取无明显差异(图 5e)。Ucp1-/- 小鼠中, 4 °C 组的肿瘤、BAT 和 sWAT 大小与 30 °C 组中的相似(扩展数据图 7c)。同样的,Ucp1 的缺失使肿瘤细胞增殖和缺氧水平恢复至热中性水平(扩展数据图 7d)。通过代谢组学分析的肿瘤糖酵解在 Ucp1-/- 小鼠中也得到了大部分恢复(扩展数据图 6k,l)。这些发现表明 UCP1 介导的脂肪组织产热机制对于肿瘤抑制是必不可少的。
附图7. UCP1缺失对健康人肿瘤微环境和BAT激活的影响
8
为了探究以上结论的人类相关性,作者对健康人和癌症患者进行了可耐受的冷暴露。招募的健康志愿者包括3 名男性和 3 名女性,年龄在 22 至 25 岁之间,连续 14 天每天暴露在 16 °C 的微冷环境温度下 2-6 h。PET 扫描分析结果显示,男性和女性组的志愿者在锁骨、颈部和胸骨旁区域的双侧区域均表现出明显的 BAT 激活(图 6a 和扩展数据图 7e、f)。BAT 激活程度在个体之间存在差异,18F-FDG 摄取结果表明成年男性和女性个体中存在大量 BAT,并且通过可耐受的冷暴露激活进而摄取较多葡萄糖(图 6a 和扩展数据图7e,f)。
接下来,作者主要对一名 18 岁的霍奇金淋巴瘤患者进行了初步研究。本研究中,该患者已接受阿霉素、博来霉素、长春碱和达卡巴嗪联合化疗5个周期。本研究是在化疗间隔的第五个周期进行的。这名患者穿着轻便的衣服,在 22°C 的轻度寒冷中暴露了 7 天。PET-CT 扫描显示在锁骨上、颈部和胸骨旁区域的双侧区域存在大量 BAT被激活,并伴随大量18F-FDG 的摄取(图 6b)。然而,将该患者暴露在温暖的 28°C 环境中 4 天,显著降低了 18F-FDG 的摄取和 BAT 的激活(图 6b)。作者使用CT 成像技术确认患者在纵隔区域存在淋巴瘤(图 6c),同时,18F-FDG 摄取实验表明,在冷暴露期间,BAT对葡萄糖的摄取显著增加,肿瘤对葡萄糖的摄取显著降低(图 6d-f)。这些初步结果表明:(1)成年人体内存在大量 BAT;(2) 在轻度可耐受的冷暴露后,BAT 被激活,并摄取18F-FDG;(3) 癌症患者BAT在冷暴露时可以被激活;(4) 癌症患者暴露于温和的寒冷条件下会显著降低肿瘤组织中的葡萄糖摄取。总之,这些人类数据将临床前发现与临床相关性牢固地联系起来,但仍然需要更严格的临床研究来验证这些结论。
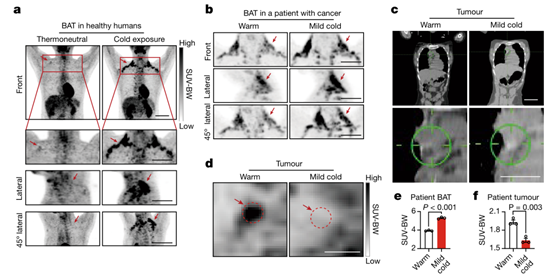
图6. 健康个体和癌症患者通过暴露于轻度寒冷中来激活BAT
总结
癌细胞的快速增殖意味着细胞的代谢机制发生了改变,其中糖、脂质、氨基酸、代谢物和气体的生物分子通过不同的代谢途径频繁交换,以促进肿瘤生长和转移。在这些代谢途径中,癌症糖酵解,即Warburg效应,可能是通过产生ATP作为能量分子支持肿瘤生长的最佳机制。积累的实验证据表明,糖酵解途径的遗传和药理学干扰显著减弱癌细胞增殖和肿瘤生长。通过寒冷和药物激活BAT的产热代谢可促进脂肪细胞的葡萄糖摄取。然而,与 BAT 激活相关的代谢变化对肿瘤生长的功能影响尚不清楚。
本文中,作者将携带肿瘤的小鼠暴露于寒冷条件下,会显著抑制各种实体瘤的生长,包括临床上无法治愈的癌症,如胰腺癌。从机制上讲,本文发现寒冷诱导的BAT 激活会显著降低血糖并阻碍癌细胞的糖酵解代谢。在冷暴露下去除 BAT 并以高糖饮食喂养可恢复肿瘤生长,而 Ucp1(BAT 产热的关键分子)基因的缺失会消除冷暴露触发的抗癌作用。同时,在人体试验研究中,作者发现轻度冷暴露会激活健康人和癌症患者的大量 BAT,同时肿瘤组织中的葡萄糖摄取减少。这些发现为使用简单有效方法的癌症治疗提供了以前未描述的概念和范例。作者预计,通过任何其他方法(例如单独或与其他抗癌疗法结合使用的药物和设备)进行冷暴露和激活 BAT 将为有效治疗各种癌症提供通用方法。
关注微信公众号代谢学人
了解更多代谢前沿资讯

https://m.sciencenet.cn/blog-3483272-1356009.html
上一篇:代谢学人--Nature:凋亡的脂肪细胞也要发挥余温!
下一篇:代谢学人-Cell&Science&Nature近期代谢精选