代谢学人
Nature综述:2型糖尿病和体重变化中表观遗传学修饰--精准医疗的辅助工具?
撰文 | 刘梓棋 郑宇含 张彦康 李雨
编辑 | 孟美瑶
校对 | 张婷

重点(Highlights)
1.T2DM是一种常见的代谢性疾病,通常与脂肪组织、骨骼肌和肝脏的胰岛素抵抗及胰岛中胰岛素分泌受损有关。
2.T2DM是一种多因素疾病,遗传因素是其中的一个组成部分,且表观遗传学或许可以解释T2DM遗传力的缺失。此外,T2DM也受到运动、饮食、肥胖和衰老等非遗传因素的强烈影响。
3.T2DM患者的多种组织中均发现包括DNA甲基化在内的表观遗传改变,并且这种改变与已知增加T2DM风险的环境因素有关。
4.人类研究解析了表观基因组如何介导遗传变异和环境暴露对T2DM和肥胖相关基因表达及细胞功能的调控作用。
5.表观遗传因素可能会受环境、遗传或其他随机因素诱导改变,这些因素共同作用决定各种细胞和组织的表观遗传特征。
6.表观遗传标记有潜力作为生物标记物,用于预测T2DM、血管并发症风险及患者对治疗或生活方式干预的响应,从而为精准医疗提供了一种工具。
摘要
2型糖尿病(T2DM)是世界上发病率增长最快的代谢性疾病。近几十年来的一系列开创性研究发现表观遗传学与T2DM之间存在关联。重要的是,这些研究在T2DM患者的胰岛、脂肪、骨骼肌和肝脏等组织中发现了包括DNA甲基化在内的表观遗传修饰变化。由于肥胖、不健康饮食、衰老和子宫内环境等增加T2DM风险的非遗传因素已被发现与健康人的表观遗传修饰改变相关,因此表观遗传可能也参与T2DM的发生发展。此外,与T2DM和肥胖相关的遗传因素同样也会影响人类组织中的表观基因组学的变化。值得注意的是,因果中介分析表明DNA甲基化可能介导了遗传因素与代谢性状及疾病之间的相互联系。近年来,基于血液的表观遗传标记物已在转化研究中被鉴定,这些标记物也许能够进一步开发并可应用于精准医疗,以帮助T2DM患者接受最佳治疗,也能够帮助鉴定具有并发症风险的患者。本综述聚焦于人类T2DM发展和体重调节过程中的表观遗传机制,并特别关注精准医疗领域。
2型糖尿病(T2DM)和肥胖属于代谢性疾病,给患者的健康和经济都带来沉重负担,并造成负面影响。这些常见疾病的患病率不断增加,甚至在儿童中也不断上升,扭转这一趋势已成为一项艰巨的任务。T2DM和肥胖除受遗传因素影响外,也受环境因素的强烈影响。此外,人体代谢具有全身性,例如,大脑发出饥饿信号和饱腹信号;各种器官会分泌激素;脂肪组织和肌肉可以储存和消耗能量等。考虑到代谢调控的复杂性,针对单一组织或途径可能不足以应对T2DM和肥胖的流行,也不能以最佳方式治疗所有这些疾病的患者。
表观基因组由多种染色质修饰组成,这些修饰可以调控基因的表达与表达时机。表观基因组的细胞特异性使得相同的遗传信息可以对不同细胞的表型多样性做出贡献并参与发育进程。近几十年来,DNA甲基化已被广泛研究。甲基化,特别是发生在CG二核苷酸中胞嘧啶上的甲基化,可能会影响基因表达。更具体地说,发生在基因启动子区域的甲基化可能会阻碍转录因子结合,因此通常会抑制转录,而发生在转录区上的甲基化则可能会增强转录活性。因此,基因附近区域的甲基化能够影响不同的基因调控元件,尽管这些区域的甲基化程度不同,但对转录都有相同的调控作用。值得注意的是,虽然表观遗传变化可以调控转录,但转录激活也会影响表观基因组。此外,组蛋白尾部的不同位置可发生甲基化、乙酰化等修饰,DNA甲基化也与组蛋白密码密切相关,从而调节染色质形成和DNA可及性。而且,表观修饰也与非编码RNA有关,其他综述已对此做出总结。
常见病的全基因组关联研究并没有像预期一样完全解释疾病的遗传性。因此可做出如下假设:基因组中还隐藏着一些仅单纯研究DNA编码不足以发现的其他信息。表观基因组也可以调控细胞表型,因此,在疾病状态下观察到的表型改变中,表观基因组也可能发挥重要作用。事实上,大量的人类研究已经证实了表观遗传学变化特别是DNA甲基化,与T2DM和肥胖等常见疾病存在关联,这些将在本综述中进行讨论。
胰岛中的表观遗传修饰
朗格汉斯胰岛是糖尿病发生发展过程中的关键组织,这些小的内分泌细胞群产生和分泌多种激素,以适当调节血液中营养物质水平和整体代谢,其中包括:胰岛素(β细胞)、胰高血糖素(α细胞)、生长抑素(δ细胞)、胰多肽(γ细胞)和胃饥饿素(ε细胞)。胰岛素是体内主要的降糖激素,它可以促进葡萄糖摄取和能量储存。T2DM通常由胰岛素抵抗引发。胰岛素抵抗会增加机体对胰岛素的需求,最初,β细胞可以补偿性分泌胰岛素,但在持续的压力下,这些细胞可能最终无法代偿,导致胰岛素分泌不足,血糖增加,最终导致T2DM。与其他类型细胞一样,表观遗传修饰调控β细胞的成熟和功能,因而也调节胰岛素分泌。例如,己糖激酶和乳酸脱氢酶A启动子上发生DNA甲基化从而导致这些基因沉默,在出生后β细胞的成熟过程中发挥重要作用。因为这些基因沉默诱导β细胞发生代谢转换,而这种转换对于葡萄糖刺激的胰岛素分泌至关重要。多项病例-对照研究发现T2DM患者的胰岛中甲基化组发生广泛变化,这些结果说明胰岛DNA甲基化在T2DM中发挥核心作用(图1)。这些研究的一个主要发现是PDX1(编码β细胞发育和功能调节因子)在T2DM患者的胰岛中表观遗传失调。例如,全基因组亚硫酸氢盐测序在T2DM患者的胰岛中鉴定出约26000个差异甲基化区域(DMRs)。其中7个DMRs被注释为PDX1,它们的区域长度和甲基化位点数量在所有DMRs中都是最高的,且平均甲基化差异程度也较大。这些DNA甲基化变化可能导致PDX1在T2DM患者胰岛中表达下调。在T2DM患者胰岛中,其他对β细胞功能有重要影响,且甲基化水平升高,表达水平降低的基因还包括INS(编码胰岛素),GLP1R(编码胰高血糖素样肽1受体),PPARGC1A(编码线粒体调节因子PGC1α)和SLC2A2(编码葡萄糖转运蛋白GLUT2)等。一些研究已对新型T2DM候选基因(包括PARK2和PID1)进行了功能验证,这些研究表明,已鉴定的DNA甲基化差异不仅可以导致T2DM患者基因表达异常,而且这些表达异常会进一步损害胰岛素分泌。然而,DNA甲基化改变与T2DM之间的因果关系还需要进一步研究(图2a)。
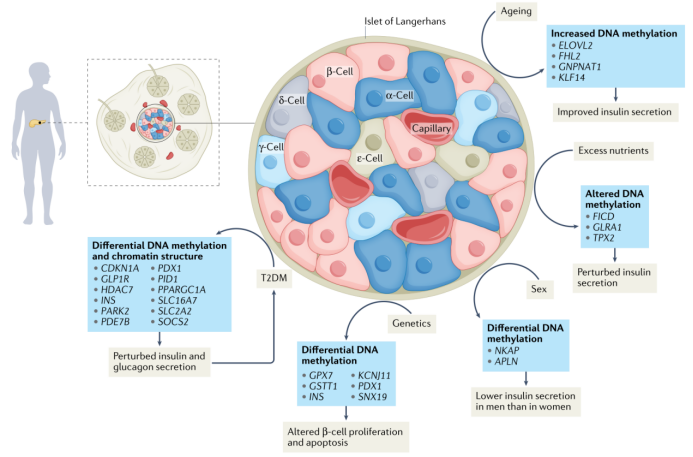
图 1 |人类胰岛的表观遗传修饰及其对胰岛素分泌和2型糖尿病的影响。衰老、营养过剩、性别和遗传因素(包括单核苷酸多态性(SNPs))等均为T2DM的风险因素,这些因素已被认为会通过改变表观遗传修饰调控胰岛和β细胞功能。过量的营养摄入、男性特征以及风险SNPs会引起大量基因的表观遗传修饰和转录组水平改变,继而导致胰岛素分泌受损,β细胞存活能力下降,增殖减少,因此可能会促进T2DM发展。然而,与衰老相关的表观遗传修饰却出人意料地与β细胞功能增强相关,这可能是胰岛代偿性反应的一部分,以对抗在衰老过程中经常发生的胰岛素抵抗。T2DM还与许多先前已知的胰岛细胞功能相关基因和/或T2DM风险相关基因的DNA甲基化改变相关。这些表观遗传修饰可能导致T2DM患者激素分泌和葡萄糖稳态失调,从而在胰岛中进一步诱导有害的表观遗传变化。本图给出了人类胰岛中DNA甲基化改变的代表性基因。
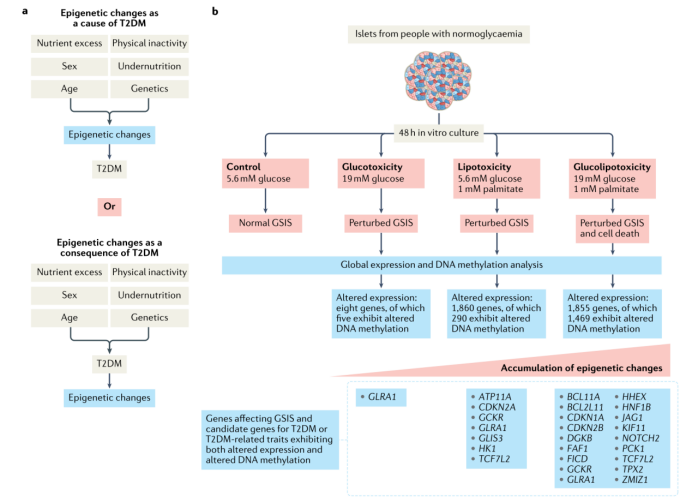
图 2 | 表观遗传修饰会导致胰岛功能障碍吗?a. 表观遗传修饰改变是导致T2DM发生的原因还是T2DM发生后的结果一直以来都存在争议。b. 对第一种观点的支持来自于对非T2DM个体胰岛的研究,当对其使用过量葡萄糖和/或棕榈酸处理时,任何一种处理都可以诱导表观遗传和转录组变化,并导致葡萄糖刺激的胰岛素分泌(GSIS)紊乱。然而,环境的 “糖尿病原性” 越高,胰岛中表观遗传变化的积累程度也越严重。因此,有些研究认为不健康的生活方式引起的血脂水平升高和/或在前驱糖尿病患者中所观察到的血糖水平升高可能引起表观遗传变化,进而诱导表型变化,从而引发T2DM。
虽然血糖水平增加是胰岛素分泌的主要驱动因素,但长期暴露于高水平的营养物质如葡萄糖和脂肪酸会导致胰岛中毒。例如,长期高水平的葡萄糖或饱和脂肪酸棕榈酸,单独或联合作用都会导致胰岛素分泌紊乱。这些状态通常被称为糖毒性、脂毒性和糖脂毒性,可能通过线粒体功能障碍、自噬受损和内质网(ER)应激等机制导致β细胞功能失调。此外,研究人员还研究了高糖、高棕榈酸或高糖和高棕榈酸联合暴露对人类胰岛DNA甲基化、基因表达、胰岛素分泌和细胞凋亡的影响。这些高水平的营养物质诱导了与胰岛素分泌受损相关的基因表达变化和DNA甲基化变化,这些结果说明,胰岛中的表观遗传修饰可能先于T2DM发生改变,且这些表观遗传修饰改变可能导致T2DM的发生(图2b)。例如,在上述任一处理条件下,相比于对照胰岛,编码甘氨酸受体的GLRA1都表现出更高的DNA甲基化水平和更低的表达水平。在体外实验中,通过小干扰RNA (siRNA)在大鼠β细胞中敲除Glra1模拟这种情况,会干扰胰岛素分泌。此外,在大鼠克隆胰岛β细胞中,高棕榈酸处理导致组蛋白修饰酶活性增加,并改变了差异表达基因的组蛋白修饰模式。例如,棕榈酸处理增加了Insig1、Lss、Peci、Idi1和Hmgcs1的表达,同时增加了组蛋白乙酰转移酶活性,并提高了与转录活性相关的组蛋白修饰水平,如组蛋白H3K9的乙酰化和组蛋白H3K79二甲基化。但这些表观遗传变化在体内能发挥多大效应目前仍不清楚。尽管这些体外实验所用的营养水平对应于T2DM患者体内的较高水平,且一些前驱糖尿病或T2DM患者体内的营养水平可能还要低于这些体外实验所用剂量,但体外处理仅持续了短短几天,而T2DM患者体内的高营养水平则会持续数年甚至几十年之久。男性患T2DM和其他代谢疾病的风险比女性更高,部分原因是因为女性的胰岛素分泌能力更强。一项针对无T2DM人群的研究表明,胰岛DNA中存在与性别相关的甲基组差异(图1)。这些差异在很大程度上是女性胰岛中的X染色体失活导致的,因为其中>90%的显著差异甲基化位点都位于X染色体上。此外,该研究还鉴定了不同性别中既发生差异DNA甲基化又差异表达的基因。在克隆大鼠胰岛β细胞中,抑制这些在男性患者胰岛中高甲基化且低表达的基因会导致胰岛素分泌受损。这一发现表明,不同性别之间的表观遗传差异可能会导致与性别相关的代谢疾病风险。此外,衰老也是与胰岛DNA甲基化水平和胰岛素分泌能力改变相关的T2DM风险因素之一(将在非遗传风险因素和表观基因组中的衰老一节进一步描述)。
目前仅在非T2DM人群的胰岛上进行了组蛋白修饰的研究,因此对T2DM患者的胰岛组蛋白修饰仍然缺乏了解。然而,一些已发表的研究鉴定了调控关键胰岛基因的染色质标记,并发现T2DM相关单核苷酸多态性(SNPs) 富集于胰岛增强子。有趣的是,一些风险SNPs似乎会导致这些增强子失活。染色质转座酶可及性测序(ATAC-seq)技术可用于分析组蛋白修饰引起的染色质结构改变。因此,ATAC-seq被用于胰岛染色质结构研究,以鉴定T2DM患者和非T2DM患者胰岛的差异。研究发现,代表开放染色质的ATAC-seq峰富集于胰岛高表达基因附近,并与T2DM SNPs位点重叠。并且,无论是一般情况下的ATAC-seq峰还是在T2DM患者胰岛中具有差异出现频率的ATAC-seq峰,这些峰都富集于胰岛转录因子的结合位点,包括PDX1、NEUROD1和NKX6.1。此外,在T2DM中具有差异出现频率的ATAC-seq峰,也与已知的T2DM候选基因如GLIS3和MTNR1B存在重叠。支持表观遗传机制介导T2DM患者β细胞功能障碍的最后一条证据是对表观遗传酶的表达分析。例如,T2DM患者胰岛中的HDAC7甲基化水平下降,表达程度上升。并且,在大鼠克隆β细胞中过表达HDAC7会导致线粒体功能障碍,并抑制葡萄糖刺激的胰岛素分泌。而在T2DM患者的胰岛中抑制HDAC7则可以改善葡萄糖刺激的胰岛素分泌水平,但对非T2DM患者的胰岛没有影响。
其他组织中的表观遗传修饰
胰岛素可通过与膜受体结合,在骨骼肌、脂肪组织和肝脏等靶组织中发挥作用,继而引发一系列下游信号转导过程,调节葡萄糖、脂质和蛋白质代谢。胰岛素抵抗情况下,体内细胞和组织对胰岛素反应不足,导致葡萄糖和脂质稳态受损。胰岛素抵抗是T2DM的预测因子,肥胖、缺乏运动、衰老和T2DM家族史等都与胰岛素抵抗相关,并且几乎所有的T2DM患者都存在胰岛素抵抗。胰岛素抵抗的病理机制非常复杂,与多种因素相关,如异位脂质堆积、细胞内信号转导紊乱、炎症细胞因子、脂肪因子、氧化应激和内质网应激等,都已被证明与肌肉和肝脏的胰岛素抵抗相关。此外,目前已经知道代谢变化会影响表观遗传酶的活性,这进而可能会导致表观基因组改变,从而调节基因表达、细胞功能和胰岛素敏感性。事实上,目前许多研究已经将人类肌肉、脂肪组织和肝脏的表观遗传改变与胰岛素抵抗和T2DM联系起来(图3)。

图3 | 人类骨骼肌、脂肪组织和肝脏的表观遗传修饰及其对胰岛素抵抗和T2DM的影响许多外部因素,衰老及遗传因素等都与T2DM靶组织(人类骨骼肌、脂肪组织和肝脏)的表观遗传改变、细胞功能受损和胰岛素抵抗有关。该图显示了在各种靶组织中与外部因素、细胞功能、胰岛素抵抗或T2DM等相关的并发生差异DNA甲基化的代表性基因。
骨骼肌
骨骼肌是胰岛素刺激下葡萄糖摄取的主要组织。与正常人相比,T2DM患者的骨骼肌表现出线粒体功能失调,糖原合成和葡萄糖转运减少。有趣的是,与年轻人(平均年龄28岁)的肌肉相比,老年人(平均年龄62岁)肌肉中编码氧化磷酸化(OXPHOS)相关蛋白的基因DNA甲基化水平升高而表达显著降低,比如NDUFB6和COX7A1。而在T2DM患者的肌肉中也同样发现这些OXPHOS相关基因表达下调。此外,PPARGC1A(编码OXPHOS相关基因的转录调节因子PGC1α)在T2DM患者肌肉中也表现出DNA甲基化水平升高而表达水平下调。值得注意的是,PPARGC1A的DNA甲基化水平在出生时体重较轻的健康人的肌肉中也增加。因此,这种表观遗传变化可能在胎儿发育期发生,从而使个体易患T2DM,但这种效应可能次于成年期后其他机制介导的转录改变。总的来说,T2DM患者肌肉中DNA甲基化的水平改变可能是线粒体功能障碍的原因。一些研究使用微阵列技术在T2DM患者及其相应对照(即未患T2DM的同卵双胞胎以及有T2DM家族史但未患糖尿病的个体)中研究了T2DM对肌肉DNA甲基化的影响。结果表明,与未患T2DM的同卵双胞胎相比,T2DM患者肌肉中PHOSPHO1基因(编码一种调控肌肉发生和线粒体功能的磷酸酶)cg02650017位点的DNA甲基化水平降低,而该位点的DNA甲基化已在全血样本中被证明与T2DM相关。有趣的是,在有T2DM家族史但未患T2DM个体的肌肉中,编码胰岛素信号通路相关蛋白的基因,如AMP激活蛋白激酶亚基PRKAB1,也表现出不同的DNA甲基化。此外,研究还发现DAPK3的甲基化水平在T2DM患者的肌肉中降低,且其甲基化水平与血糖水平呈负相关,而胰岛素暴露则会增加其甲基化水平。在整个生命进程中,骨骼肌通过肌肉发生进行再生和维持,在该过程中,激活的肌肉干细胞(卫星细胞)会增殖,其中的成肌细胞亚群会分化形成肌管,然后与肌纤维或其他分化的肌肉细胞融合。来自T2DM患者的卫星细胞对易诱发糖尿病的环境仍然保持着细胞记忆,如受损的葡萄糖转运等,这其中可能涉及到表观遗传机制。事实上,在肌肉发生过程中,T2DM患者的肌肉细胞表现出异常的表观遗传变化,其改变的DNA甲基化位点数量是对照个体的两倍。这些在肌肉发生过程中的DNA甲基化异常可能是由于负责从头甲基化的DNA甲基转移酶(DNMTs)调节受损所致。事实上,T2DM患者肌管中DNMT3B的蛋白水平确实增加,而DNMT3A和DNMT3B也只在来源于T2DM患者的肌肉细胞分化过程中表达上调。该研究还发现,T2DM患者的成肌细胞和肌管中的VPS39表达也低于无T2DM个体。而在人成肌细胞中沉默VPS39会影响自噬通量、胰岛素信号、表观遗传酶、DNA甲基化和肌生成调节因子表达,从而导致肌肉发生受损。总的来说,肌肉细胞的表观遗传异常可能可以部分解释胰岛素抵抗和T2DM患者肌肉重量与质量的降低(图3)。虽然肌肉的表观遗传改变似乎导致T2DM发展,但还需要更多的大型研究来进一步夫复现和解析肌肉中组蛋白修饰的作用。
脂肪组织
脂肪组织可通过其内分泌调控功能和储存甘油三酯的能力调节全身葡萄糖和脂质稳态。脂肪生成和脂肪组织功能同样受表观遗传机制调控 (图3)。例如,DNMT3A介导脂肪组织的胰岛素抵抗。此外,胰岛素抵抗与脂肪组织中炎症细胞数量增加也具有明显关联,在代谢综合征患者的内脏脂肪组织(VAT)和HbA1c水平升高或T2DM患者的皮下脂肪组织(SAT)中发现了编码炎症相关蛋白基因或HLA区域的差异甲基化。这些表观遗传修饰与炎症可能互为因果关系。此外,子宫内环境受损,也会导致新生胎儿出生体重更轻,并增加未来患代谢性疾病和T2DM的风险。出生时体重较轻的健康年轻男性(23-27岁) 出现胰岛素抵抗性的可能性比出生时体重正常的男性更高,并且SAT中的T2DM相关基因DNA甲基化水平也存在差异,比如FADS2基因,该基因编码一种去饱和酶,在高脂肪喂养后上调。另一项研究发现,与出生时体重正常的男性相比,出生体重较轻男性的SAT中编码瘦素和脂联素基因的DNA甲基化程度更高,且其甲基化水平与全身体脂率呈正相关。VAT增多会促进胰岛素抵抗。与正常女性相比,胰岛素抵抗女性的VAT和SAT中发现一组共同基因发生了差异甲基化,其中一些基因编码胰岛素信号相关蛋白。而且,在T2DM患者的VAT中也发现HOOK2基因高度甲基化。此外,与肥胖但胰岛素敏感性正常的个体相比,肥胖且胰岛素抵抗患者的VAT中某些基因如TET1,ADAM2和FASN等甲基化水平也存在差异。另一项研究也发现,在SAT中,T2DM与一些miRNA基因的DNA甲基化水平升高和表达水平降低相关,如miR-30和let-7家族。并且,miR-30a启动子甲基化水平增加直接降低了其转录活性。在脂肪细胞中沉默miR-30也抑制了细胞中葡萄糖摄取及TBC1D4磷酸化水平,并减少了与DNA去甲基化相关(如TET1)以及与碳水化合物、脂质和氨基酸代谢相关的基因表达,同时上调了炎症相关基因表达。TET1是miR-30家族的预测靶点之一,在T2DM患者的脂肪组织中表达下调。值得注意的是,一些研究证明了脂肪组织中TET1的表观遗传调控与胰岛素抵抗之间存在联系。此外,ABCG1编码一种ATP结合盒蛋白,这种蛋白可以从外周组织中去除多余的胆固醇并转运至肝脏。在T2DM患者的SAT和全血样本中,ABCG1的DNA甲基化水平均增加。此外,血液中ABCG1甲基化水平升高与T2DM发生具有关联。近几年的研究表明,在非裔美国人和南亚印度人中,脂肪组织DNA甲基化也分别与胰岛素抵抗和代谢稳态具有相关性,而编码前阿黑皮色原的POMC甲基化也与胰岛素抵抗有关。人类脂肪组织的表观遗传学研究主要集中在DNA甲基化上,有必要对组蛋白修饰在胰岛素抵抗和T2DM中的作用也进行解析。未来还应继续在脂肪组织中探索表观基因修饰是否会导致代谢异常。
肝脏
为了维持葡萄糖稳态,在进食之后,机体会分泌胰岛素抑制肝脏糖异生,刺激肝脏合成和储存糖原,而在禁食状态下,胰高血糖素刺激肝脏糖异生和葡萄糖分泌。而胰岛素抵抗和T2DM状态打破了这种平衡,从而导致高血糖。一些研究已经通过研究人类肝脏样本,探索了DNA甲基化在T2DM中的作用。其中一项研究发现肥胖且T2DM患者的肝脏中有251个位点的甲基化水平与肥胖但血糖正常个体的肝脏不同。有趣的是,在T2DM患者中,这些位点中的大多数DNA甲基化水平降低,并且甲基供体叶酸的循环水平也降低了。例如,GRB10的甲基化水平在T2DM患者肝脏中较低。与该结果相一致,一些研究发现T2DM患者一级亲属肌肉中GRB10甲基化水平比无T2DM家族史个体肌肉更低,并且T2DM风险SNPs与人类胰岛中GRB10甲基化之间存在关联。T2DM患者肝脏中,许多甲基化水平降低的基因同样表达增加,例如,编码炎症激活因子的RIPK4和编码lncRNA的H19 。一项小鼠研究表明,肝脏H19水平升高会导致高血糖。此外,编码重要胰岛素信号分子的IRS2,在T2DM患者的肝脏中表达水平下调,且其表达与肝脏中的DNA甲基化水平相关。另一项研究发现,T2DM患者肝脏中PDGFA的甲基化水平降低,而该基因座的DNA甲基化水平通常与抑制肝纤维化、减少的丙氨酸转氨酶水平和天冬氨酸转氨酶水平相关。此外,该研究还发现PDGFA会负调控胰岛素信号通路。DPP4在非酒精性脂肪性肝病患者的肝脏和饮食诱导糖尿病小鼠的肝脏中上调,并且人肝脏DPP4甲基化水平与其表达相关。总的来说,这些研究表明,在人类肝脏中,调节胰岛素信号转导和炎症相关基因的DNA甲基化参与了T2DM的发病机制(图3)。
一些研究也试图将人类肝细胞中的组蛋白修饰与T2DM联系起来。例如, SLC16A11是一种质子偶联的单羧酸盐转运蛋白,抑制SLC16A11会改变脂质代谢。一种T2DM风险单倍型变异与SLC16A11表达减少相关,在肝脏中,SLC16A11附近的T2DM变异风险位点具有激活型组蛋白标记H3K27ac的等位基因倾斜。在肝细胞中的另一项研究则表明GCKR的内含子单倍型变异与组蛋白H3K27ac修饰水平升高相关,从而进一步增加FOXA2结合并促进GCKR表达。这些结果提示组蛋白修饰可能与T2DM发病机制具有潜在联系。
非遗传风险因素和表观基因组
体育活动
生活方式干预如体育运动和健康饮食,比二甲双胍更能有效地降低高危人群T2DM的发病率,这可能与表观遗传修饰的改变有关。有项研究支持了这一假设,其研究发现对久坐的男性进行运动干预可改变肌肉和脂肪组织中DNA甲基化和基因表达水平,例如,运动后,RUNX1、MEF2A和PPARGC1A的甲基化水平下降,T2DM候选基因如TCF7L2、KCNQ1、FTO和THADA的甲基化也表现出降低或升高。同样,单腿训练3个月,与未训练的那条腿相比,运动诱导肌肉中约5000个DNA位点发生了差异甲基化修饰,包括RUNX1附近的位点,该位点编码一种调节肌肉再生的转录因子。然而,也有研究发现运动并不能诱导肌肉中DNA甲基化修饰的改变。但重要的是,长期体育运动与肌肉中肌肉生成和代谢相关基因的低甲基化有关。急性运动也可降低一些基因的甲基化修饰,如肌肉中PPARGC1A和脂肪相关基因。也有研究发现阻力训练可调控人类肌肉中线粒体相关基因的甲基化水平。这进一步表明运动可影响肌肉中DNA甲基化修饰。
有一些研究探究了运动干预对T2DM患者肌肉中DNA甲基化的影响。发现阻力训练显著降低了SLC1A4(编码GLUT4)基因启动子位点的甲基化水平。此外,10周有氧训练可改变GSTM1和GSTM5基因的甲基化水平,这一变化与磷酸肌酸恢复率有关。
在血液样本中,体育运动与整体甲基化的增加、某些基因位点的差异甲基化以及GrimAge有关。GrimAge是一个“表观遗传钟”,可根据细胞内DNA甲基化模式预测个人的剩余寿命。此外,有研究发现在40-87岁人群中,高强度间歇性行走运动与血液中ASC(负责IL-1β和IL-18分泌的蛋白编码基因)甲基化的增加有关。
有趣的是,进一步研究发现运动干预可改变人类精子中的DNA甲基化,这揭示了一种运动调控跨代表观遗传的潜在机制。此外,肥胖孕妇的体育运动与后代脐带血中379个DNA位点差异甲基化有关。且孕妇的生活方式干预可显著降低脐带血中与母体妊娠糖尿病相关的甲基化特征。总之,体育活动可改变DNA的表观修饰,这可能会进一步影响转录组、细胞功能和代谢性疾病风险(图3)。然而,这需要在更多人群中作进一步研究,以确定体育运动是否通过调控基因的表观遗传修饰,来影响健康和改善T2DM。
饮食干预
营养过剩可引起胰岛素抵抗和胰岛功能障碍,而某些饮食如低热量或低脂肪饮食可降低T2DM风险。为了剖析这些生理现象的潜在分子机制,研究人员在人群中研究了饮食和表观遗传修饰之间的联系(图3)。一项研究表明,年轻健康男性(24-27岁)过量饮食5天可引起外周胰岛素抵抗,并以出生体重依赖的方式增加肌肉中PPARGC1A甲基化水平并下调PPARGC1A表达。也有研究发现过量饮食会引起正常出生体重的男性肌肉中广泛的DNA甲基化改变,而出生体重较轻的男性肌肉中只出现少量DNA甲基化改变。此外,过量饮食也可改变脂肪组织中652个DNA位点的甲基化修饰,如上调SLC2A4(编码GLUT4)的甲基化。且短期过量饮食也会引起肌肉中809个DNA的差异甲基化水平。此外,一些饮食如热量限制或禁食,可能通过调控表观遗传修饰来发挥有益健康的作用。事实上,禁食36小时可改变肌肉和脂肪中一些基因的甲基化修饰,包括编码脂肪因子的相关基因。此外,对唾液和血液进行甲基化分析发现,健康的饮食方式与“表观遗传年龄”的降低有关。进一步研究发现热量限制引起体重下降这一现象与血液中NFAT2IP的甲基化修饰密切相关,有趣的是,NFAT2IP较低水平的甲基化修饰和较高水平的基因表达显著降低了高脂饮食人群的体重,而在低脂饮食人群中并没有明显作用。在健康人群中,过度摄入饱和脂肪酸会促进肝脏和VAT的脂质储存,而过度摄入多不饱和脂肪酸会增加肌肉含量。此外,富含多不饱和脂肪酸的等热量饮食可改善肥胖和T2DM患者的肝脏脂质积累现象。研究表明,过量摄入多不饱和脂肪酸上调了脂肪组织1795个基因(如FTO、IL6和POMC)的平均甲基化水平,但下调了2个基因的甲基化水平。然而过度摄入饱和脂肪酸只上调了125个基因的甲基化水平。与这一发现一致的是,几项研究发现富含多不饱和脂肪的地中海饮食与血液中CPT1B、SOCS3等基因的差异DNA甲基化密切相关。此外孕妇饮食中多不饱和脂肪酸和饱和脂肪酸的比例与新生儿唾液中的“表观遗传年龄”有关。且有研究发现碳水化合物的摄入量与血液中CPT1A的甲基化呈正相关,而脂肪摄入量与血液中CPT1A的甲基化呈负相关关系。
衰老
衰老是T2DM的主要风险因素之一。衰老相关的表观遗传修饰已在T2DM患者关键的代谢组织中进行了广泛研究(图1,3)。研究表明表观遗传修饰失调可引起线粒体功能障碍,而线粒体功能障碍是衰老和T2DM的一个共同标志。在肌肉中,衰老会引起COX7A1和NDUFB6的甲基化水平增加以及基因表达水平下降,进而影响体内胰岛素介导的葡萄糖摄取过程,这表明DNA甲基化修饰在衰老引起的T2DM中发挥着重要作用。此外,肌肉中衰老与DNA甲基化的联系在全基因组范围内也进行了研究。Meta分析发现,在所有DNA位点中,有6%与衰老相关,主要富集在基因增强子和转录起始位点附近。GO分析显示这些位点主要与肌肉发育和收缩功能相关。组蛋白标记分析还发现肌肉组织中H3K27ac(H3K27乙酰化,表征激活的增强子)水平随着年龄的增长而升高。与衰老相关的DNA甲基化修饰也被认为是老年人(72-80岁)肌肉细胞更新能力下降的基础。例如,在老年人的肌肉祖细胞中SPRY1(自我更新调节因子)的甲基化水平升高以及基因表达水平下降,而通过药物治疗诱导SPRY1的去甲基化修饰,可促进SPRY1基因表达水平,进而促进老年人肌肉祖细胞自我更新正常化,然而,敲除SPRY1基因可抑制这一现象,这表明SPRY1的表观遗传修饰在老年人肌肉再生过程中发挥着重要作用。此外,有研究表明阻力训练有助于改善老年人的肌肉功能,这是由于阻力训练抑制了肌肉细胞中衰老相关的DNA甲基化修饰。
在人类胰岛、肝脏和脂肪组织中也发现了衰老相关的甲基化修饰(如KLF14、ELOVL2和FHL2的甲基化修饰)。在克隆β细胞中探究胰岛的功能,发现衰老相关的甲基化修饰与葡萄糖刺激的胰岛素分泌功能有关,这表明衰老相关的甲基化修饰参与调控了胰岛的补偿机制。在衰老小鼠(16-20月龄)的胰岛中也发现衰老改变了DNA甲基化修饰,这一表观修饰的改变可能是衰老小鼠β细胞增殖能力下降但胰岛素分泌增强的原因。虽然研究人员们对肝脏和脂肪组织中衰老相关的DNA甲基化功能还知之甚少,有趣的是,肥胖作为T2DM的风险因素之一,促进了人类肝脏和VAT的表观遗传衰老。此外,在血液中也检测出一些与衰老相关的差异甲基化修饰,这表明血液中的甲基化水平可作为T2DM靶组织整体甲基化状态的生物标志。一项对前瞻性队列的血液分析发现,血液甲基化水平还与机体未来的胰岛素分泌水平以及T2DM风险降低呈正相关,这表明衰老相关的胰岛甲基化改变具有保护作用。
基因和表观遗传的相互作用
常见的遗传变异只能部分解释与T2DM和肥胖相关的风险,剩余的遗传易感性(即缺失的遗传力)可能由罕见的基因变异或只带来较小风险的基因变异,以及基因—环境间的相互作用所解释。因此,T2DM和肥胖的易感性主要取决于部分基因位点和环境因素之间的复杂相互作用,即表观遗传现象,所以我们需要考虑多层次的遗传信息。
研究表明DNA甲基化是基因突变体引起T2DM或肥胖的潜在机制之一。基因突变体可通过直接去除或引入CG二核苷酸(甲基化位点)来影响细胞中DNA甲基化水平,也可通过间接影响表观遗传修饰相关酶或蛋白的结合位点来调控细胞内的DNA甲基化修饰(图4)。值得注意的是,研究报道约有23% SNP属于CpG-SNPs(即通过去除或引入CG二核苷酸改变DNA甲基化水平)。此外在携带FTO风险等位基因的患者血液中也发现DNA差异甲基化现象,且KCNQ1基因的CpG-SNP甲基化水平与胰岛素敏感性密切相关。另一项研究发现,在与T2DM相关的SNPs中,几乎50% SNPs属于CpG-SNPs。此外,对CpG-SNPs的DNA甲基化分析显示SNPs也与人类胰岛整体甲基化修饰密切相关,研究发现WFS1、CDKAL1和TCF7L2的CpG-SNPs与可变剪切有关,而ADCY5、HHEX、KCNQ1和CDKN2A的CpG-SNPs与胰岛素含量、胰岛素分泌以及胰高血糖素分泌相关。这表明表观遗传修饰可能是基因突变体介导T2DM的潜在机制。
为了更深入探究表观遗传修饰在T2DM遗传因素中发挥的作用,一项研究对人类胰岛的基因和表观遗传修饰进行了全基因组关联分析,发现6.4%的SNP基因位点与甲基组(the methylome)之间存在顺式相互作用,包括已知的T2DM相关基因如INS、KCNJ11、PDX1和ADCY5。此外,基因与表观遗传因子的相互作用也影响了人类胰岛中的mRNA表达水平和胰岛素分泌水平。对脂肪组织进行类似方法研究,发现有10万多个SNP位点与DNA甲基化修饰相关,进一步研究显示这些SNP可影响脂肪组织mRNA的表达水平。此外其他研究也表明脂肪组织DNA甲基化部分受基因调控。这表明DNA甲基化在SNPs介导T2DM相关代谢表型中发挥重要的作用。
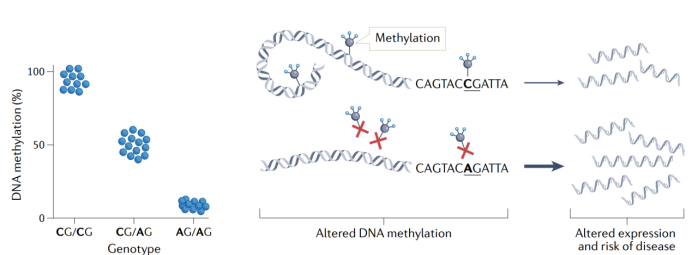
图4 | 基因突变和表观基因组之间的相互作用。去除或引入CG二核苷酸的单核苷酸多态性(即CpG-SNPs)可直接调控DNA的甲基化,进而影响mRNA表达水平和疾病发生风险。图中显示了C到A的SNP破坏了一个CG二核苷酸,即去除一个甲基化位点。纯合CG携带者有两个可能发生DNA甲基化的等位基因,而杂合携带者只有一个CG等位基因,因此杂合携带者甲基化水平通常仅有一半。纯合非CG(即AG)携带者没有发生DNA甲基化的位点。此外,启动子区域内的DNA甲基化通常通过抑制转录因子与基因的结合或通过招募甲基结合蛋白以减少基因表达,而基因内甲基化被认为能促进基因表达。
随着生物信息学的发展,我们现在可以检测SNPs、DNA甲基化和mRNA表达或任何生理表型之间的关联。研究人员利用孟德尔随机化确定了肌肉中213个基因的DNA甲基化与mRNA表达之间的关系,并进一步将肥胖和T2DM相关基因位点的DNA甲基化与基因表达联系起来,从而将分子与生理表型联系起来。此外这项研究也进一步强调了组织特异性生物学对疾病发展研究的重要性。且基因的表观遗传修饰也解释了为什么具有不同遗传背景的人群在肥胖或T2DM发展方面会存在差异,其原因可能有:不同种族的人群携带CpG-SNPs基因突变体的等位基因频率有所差异,环境应激可能对基因的表观遗传修饰产生不同的影响,这些因素进一步对基因表达和疾病的发生风险产生了不同的影响。
用于精准医学的表观遗传学
T2DM的血管并发症是导致患者死亡的主要原因,而高水平的血糖会增加心血管疾病和肾脏疾病的发生风险,因此确定T2DM及其并发症的高危人群对疾病预防至关重要,同时,已确诊的T2DM患者及时接受最佳降糖治疗也很关键。因此,十分需要可应用于临床的生物标志来预测T2DM、T2DM并发症及其治疗反应。一些研究已探究了血细胞中DNA甲基化与疾病的发生密切相关,而这些标志未来有望应用于肥胖和T2DM的精准医疗中(图5)。此外,一些研究表明靶向表观遗传修饰也是一种有效的治疗手段,这也可能成为精准医学中新的治疗选择(图6)。
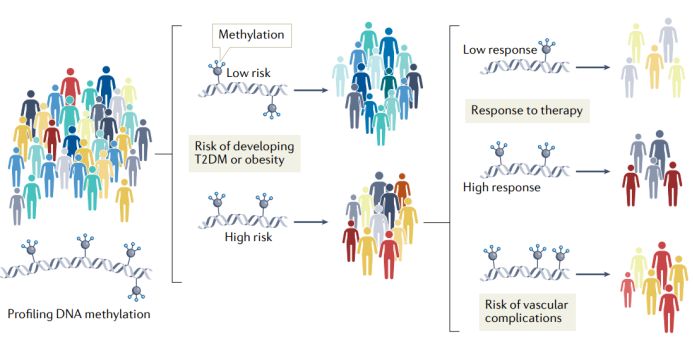
图5 | T2DM和肥胖症精准医学的表观遗传生物标志物。血液中可以很容易地分析DNA甲基化。因此,血液中的DNA甲基化标志物可以区分疾病风险人群和无风险人群,以及治疗应答者和无应答者,并可能被开发成可用于临床的生物标志物。因此,通过分析特定的DNA甲基化标志物,可以预测T2DM或肥胖的风险,从而在高危人群中(尤其是在发生血管并发症的人中)采取预防措施。表观遗传生物标志物也可用于预测治疗反应,从而指导治疗方案选择,以达到最理想的效果。
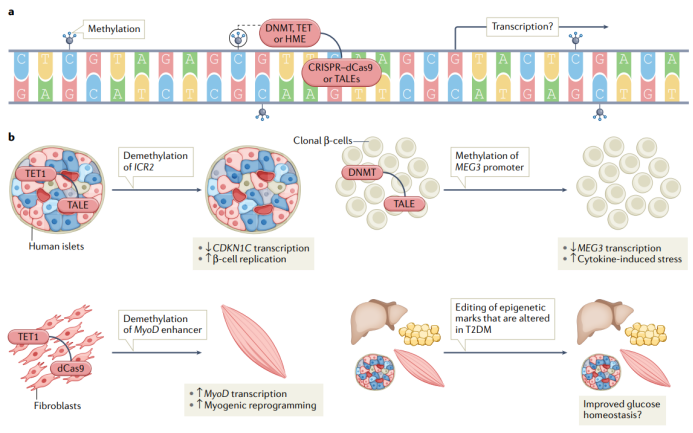
图6 | 靶向基因表观遗传修饰治疗T2DM。a.通过将转录激活因子样效应因子(TALEs)或酶促死亡Cas9(dCas9)与表观遗传酶(DNA甲基转移酶(DNMTs;催化DNA甲基化修饰)、10-11易位甲基胞嘧啶二氧酶(TETs;催化DNA去甲基化修饰)或组蛋白修饰酶(HMEs))结合,可对基因组的表观遗传修饰进行编辑;TALE或dCas9与导向RNA结合可靶向到特定基因位点,从而在表观遗传修饰相关酶的催化下对基因的表观遗传修饰进行编辑,进而影响基因的转录活性。b.利用表观遗传编辑技术对人类胰岛、克隆β细胞和成纤维细胞中的特定基因进行表观遗传修饰编辑,从而导致细胞功能的改变。然而,对T2DM相关的表观遗传标志进行编辑,是否可改善患者糖稳态,还有待进一步研究。ICR2,印记控制区2。
血液中的表观遗传标志与T2DM的发生有关
确定T2DM风险人群有助于对目标人群进行早期预防如生活方式干预,从而减少患者数量。因此,迫切需要具有高预测T2DM能力的生物标志。基于血液中的表观遗传标志容易被分析,可能有效应用于临床。而有意思的是,一项研究发现,全血样本中ABCG1、PHOSPHO1、SOCS3、SREBF1和TXNIP的甲基化修饰以及综合甲基化评分与T2DM的发生密切相关,且这些甲基化信号在其他前瞻性队列研究中也得到了验证。另一项研究还发现了全血样本中15个新的基因甲基化位点(如CPT1A)与T2DM发生有关,然而在一个独立队列研究中发现这15个新的基因甲基化位点并不能有效预测T2DM的发生。但是,孟德尔随机化分析显示CPT1A甲基化可能与T2DM发展有直接联系,墨西哥裔美国人家庭7.8%的T2DM遗传性可归因于TXNIP、ABCG1和SAMD12的甲基化。对Botnia队列(来自芬兰西部)进一步分析发现,全血样本中KLF14、FHL2和GNPNAT1的甲基化与T2DM发生密切相关。此外,GrimAge能够预测死亡和冠心病发生时间,且年龄校正后的PAI1甲基化修饰水平与T2DM发生有关。另一项研究表明,GrimAge部分介导了肥胖累积和T2DM发展之间的关联。最后,一项研究报道,在人类血液样本中,多个基因的DNA甲基化与T2DM发生有关,并且在易感小鼠发生T2DM之前,这些基因便已在胰岛中显示出甲基化修饰失调现象。
总之,这些研究已经确定了血液中与T2DM发生相关的DNA甲基化标志(图5)。然而,在表观遗传生物标志应用于临床之前,还需要更多的研究,如寻找比家族遗传信息或人类测量学数据具有更高预测T2DM能力的表观遗传标志,此外已确定的表观遗传标志还需要在不同的大型队列中进行重复验证。
与肥胖和体重变化有关的表观遗传标志物
越来越多的研究揭示了与肥胖和体重变化相关的表观遗传标志。早在2010年就发现了淋巴细胞和白细胞中的DNA甲基化模式与BMI有关。几年后,人们又发现血液和脂肪组织中HIF3A的甲基化与BMI有关,且这些发现也在其他研究中得到证实。此外,研究还发现脐带血中HIF3A甲基化与出生时的体重和体脂有关,外周血中HIF3A甲基化与儿童期肥胖有关。然而,有些研究并不支持HIF3A甲基化调控BMI水平这一因果关系,而是表明BMI影响了HIF3A甲基化水平 。同样,另一项研究也表明血液中DNA甲基化水平的改变主要是肥胖的结果,而不是肥胖的原因。然而,孟德尔随机化分析显示NFATC2IP甲基化可以预测体重增加,提示NFATC2IP甲基化对BMI的调节可能具有因果作用。此外,在血液样本中发现了83个与BMI相关的DNA甲基化位点,其中SREBF1的甲基化似乎与BMI有因果关系,并与肥胖相关疾病如冠状动脉疾病有关。Meta分析结果显示血液中有52个基因甲基化修饰与BMI相关。有趣的是,一些研究还将脐带血或出生时/生命早期抽取的血液中的DNA甲基化模式与日后的肥胖和生长状况联系起来。另一研究也表明,血液中的DNA甲基化可以预测“健康的”肥胖向“不健康的”肥胖的进展。总之,肥胖明显影响了人类的表观遗传修饰;然而,血液中一些DNA甲基化也与未来体重增加与肥胖的发生风险有关(图5)。未来的研究应该进一步剖析DNA甲基化是否以及如何诱导肥胖,表观遗传修饰和基因如何综合诱发肥胖,以及已鉴定出的表观遗传标志是否可以应用于临床研究。此外,由于免疫细胞和炎症均可影响肥胖和T2DM的发生,因此了解血细胞中的DNA甲基化是否在代谢性疾病的发生中发挥作用也很重要。
用于预测代谢性疾病治疗反应的表观遗传学
美国糖尿病协会和欧洲糖尿病研究协会于2020年发表的一份共识报告强调了糖尿病的精准医疗需求。约30% T2DM患者对一线治疗药物二甲双胍没有反应,但目前临床上还没有有效的生物标志来预测患者对二甲双胍治疗的血糖反应效果。然而,一项研究发现,在还未用药的T2DM患者血液样本中,有11个DNA甲基化修饰与患者未来对二甲双胍治疗的血糖反应有关,且这11个DNA甲基化在对二甲双胍有良好反应和无反应患者之间存在显著差异,这表明其可作为临床研究中用于预测患者对二甲双胍治疗反应的生物标志(图5)。而对于药物治疗效果不佳的T2DM患者,其可使用GLP1类似物和钠-葡萄糖协同转运蛋白2抑制剂等替代药物。值得注意的是,研究发现VTRNA2-1的低甲基化水平与患者对GLP1类似物的治疗反应不佳有关。健康饮食、体育活动以及减肥手段如低热量饮食或减肥手术也可用于治疗T2DM。研究表明通过低热量饮食方式成功减肥的肥胖女性,其基线时编码瘦素和TNFα的基因甲基化水平显著低于对饮食干预治疗无反应的肥胖女性。
他汀类药物(Statins)可以降低血浆低密度脂蛋白水平和心血管疾病的发生风险,因此经常用于T2DM患者。研究发现他汀类药物治疗会在T2DM或非T2DM患者血液中导致DHCR24、SC4MOL和ABCG1的DNA差异甲基化,进一步分析表明,DNA甲基化部分介导了他汀类药物对低密度脂蛋白水平、胰岛素抵抗和T2DM风险的疗效。
虽然目前已有些药物表观遗传学(pharmacoepigenomic)的研究结果,但在将表观遗传生物标志应用于临床并帮助T2DM接受最佳治疗之前,还需要做更多的研究工作(图5),例如,研究人员需要在随机对照实验中进一步验证已确定的生物标志,此外也需要在不同的大型队列和不同人种中重复验证表观遗传生物标志预测患者治疗反应的准确性。
预测糖尿病患者患血管并发症的表观遗传学
表观遗传修饰与糖尿病患者的血管并发症有关,而DNA甲基化与糖尿病患者的血管并发症发生风险密切相关。例如,在患有T2DM的皮马印第安人(Pima Indian individuals)中,一些基因位点的甲基化修饰与肾功能衰退有关,而有一些基因的低甲基化修饰被认为是糖尿病肾病的早期标志。此外,研究表明GrimAge与周围神经病变和心血管自主神经病变的发展有关。且AHRR、GIPR和GLRA1的甲基化以及全基因组整体甲基化的增加都与糖尿病视网膜病变的发生有关。总的来说,为了确定可应用于临床有效预测糖尿病并发症发生发展相关的表观遗传标志,研究人员还需做更进一步的研究(图5)。
靶向表观基因组可作为T2DM和肥胖治疗的新方法
一些用于治疗T2DM或肥胖的药物通常会改变基因表观遗传修饰,并可能通过表观遗传机制发挥作用。在这方面,二甲双胍和他汀类药物被广泛研究,例如,在人源肝细胞中,二甲双胍改变了编码二甲双胍转运体的DNA甲基化模式,也可部分通过调控组蛋白修饰酶SIRT1和GCN5的蛋白水平和活性来发挥作用。也有研究在来自Simpson-Golabi-Behmel综合征患者的前体脂肪细胞系中发现,他汀类药物治疗可上调HDAC9蛋白水平,进而抑制ABCG1(调控胆固醇外排)的基因表达,从而损害脂肪生成、胰岛素敏感性和葡萄糖摄取。肠促胰岛素药物也被发现可通过调控Fxyd3的表观遗传修饰水平影响大鼠的β细胞功能,并改善大鼠由于出生前在子宫内发育迟缓而引起的表观遗传学诱导的β细胞损伤现象。
此外,通过药理学抑制表观遗传修饰相关酶(如HDAC7和HDAC3)来改变基因表观遗传修饰,也可能是T2DM的一种有效治疗方法,目前这类抑制剂正在用于癌症治疗或试验。研究发现,T2DM患者的组织和细胞中表观遗传修饰相关酶的表达或活性发生了改变,而调控DNA甲基化或组蛋白的酶抑制剂可显著影响β细胞的功能,其中HDAC抑制剂MC1568对人类胰岛的改善作用已在前一节中讨论。相关工作主要来自于Thomas Mandrup-Poulsen实验室,例如,抑制HDAC3可保护β细胞免受细胞因子诱导的细胞死亡和糖脂毒性,还可改善T2DM肥胖大鼠的葡萄糖稳态。此外,在T2DM动物模型中,I类HDAC抑制剂治疗可促进肌肉和脂肪组织中PGC1α活性,提高肌肉和脂肪组织的氧化代谢,从而降低体重,并改善肝脏健康和血糖稳态;且利用丁酸(一种I类和II类HDACs抑制剂)治疗HFD小鼠,也对PGC1α和代谢稳态产生了类似的改善作用。
虽然本文所总结的研究结果均表明表观遗传修饰抑制剂对T2DM的治疗有益,但需要注意的是,表观遗传修饰的抑制在不同的组织中可能会产生不同的影响。例如,虽然已有研究表明药理抑制HDAC3活性或HDAC3基因缺失可改善β细胞的功能,但HDAC3在骨骼肌或心脏中的缺失会分别导致严重的胰岛素抵抗或HFD诱导的死亡。因此,控制表观遗传修饰抑制水平,或调控抑制剂特异性靶向于某些基因位点、组织或细胞,可能是安全有效治疗T2DM的必要条件。
在过去的十年中,人们已经开发出一种能够特异性改变基因组表观修饰的技术:序列特异性表观遗传编辑技术,这项技术是基于蛋白质与具有序列特异性的DNA结合,如转录激活因子样效应蛋白(TALEs)或酶促死亡CRISPR相关蛋白9(dCas9)与导向RNA(gRNA)结合(图6);当这些蛋白质与表观遗传修饰相关酶的催化结构域结合时,可通过序列特异性方式编辑染色质上的表观遗传标志。利用这一技术直接证明了表观遗传修饰变化可调控基因的表达水平和功能,也表明表观遗传编辑技术有望成为T2DM新的治疗方法。研究表明T2DM患者胰岛细胞中DLK1-MEG3启动子的甲基化失调,导致MEG3表达下降,并促进胰岛细胞中细胞因子诱导的氧化应激反应,而利用与DNMTs或TET1结合的TALEs对ICR2(印记调控区2)进行编辑,降低ICR2的甲基化修饰,可导致CDKN1C(细胞周期抑制剂)表达降低,从而增加胰岛中β细胞的增殖。同样,也有研究表明结合TET1的dCas9也可诱导MyoD远端增强子发生去甲基化修饰,促进MyoD的表达,从而促进成纤维细胞重编程为成肌细胞。总之,这些研究表明了利用表观遗传编辑技术可促进β细胞增殖以及肌肉细胞的产生,说明表观遗传编辑技术有望成为改善T2DM患者肌肉功能和β细胞功能新的治疗方式。而在未来的研究中,还需要进一步探究利用表观遗传编辑技术靶向T2DM相关的表观遗传标志是否可有效改善糖稳态失调现象,以及是否可以通过移植编辑细胞或直接体内编辑途径来实现T2DM患者糖稳态的改善(图6)。
进一步的研究提示我们,表观遗传编辑技术有望成为未来治疗T2DM和肥胖的有效手段,包括开发更特异性的蛋白来调控表观遗传修饰相关酶活性,以及开发靶向递送表观遗传修饰因子(药物或表观遗传编辑)的方法,如将多肽、核酸、纳米颗粒或抗体等递送到特定的组织或细胞中,而这一构想正在癌症治疗的临床试验中进行检测。
总结
在过去的十到十五年中,表观遗传修饰与T2DM的研究在科学界掀起了一阵浪潮。我们知道,环境可通过表观遗传机制影响基因功能,从而调控T2DM的发病机制(图7)。但目前仍有许多问题需要进一步探究,例如,还需要全面绘制不同组织中组蛋白修饰的图谱,以研究环境是如何影响表观遗传修饰,以及如何进一步影响疾病的发生发展。对于所有的表观遗传修饰,我们还需要进一步探究其发生的因素,从而区分它们是可遗传的表观遗传修饰还是环境诱发或随机发生的表观遗传修饰(图7)。然而,在目前的研究中,从人体中获取代谢活跃的组织是一个限制因素,而且研究的人群也比较同质化。因此,未来的研究需要涵盖生活在不同环境下和具有不同遗传背景的人群。
组织异质性也可能影响研究结果,而单细胞技术将会解决这一问题,提高研究结果的精确度,并且更大型的队列和重复队列也可以帮助我们明确表观遗传修饰对代谢性疾病发生发展的重要性。此外,我们还需要进一步探究发生表观修饰改变的组织之间的交流、表观遗传修饰的改变是否会导致疾病的发生以及这些表观遗传修饰是否可以作为疾病治疗的靶点。有研究表明,血液中部分表观遗传修饰变化与代谢组织中表观遗传修饰变化类似,然而,这一现象的调控机制目前还没有研究。此外,我们还需要进一步探究几种表观遗传修饰是否会共同导致疾病的发生,以及如何导致的。综上所述,与代谢性疾病相关的表观遗传学正在迅速发展,而目前和未来的研究将为代谢性疾病的精准医疗提供有效的方法,以更好地预测T2DM和肥胖的发生发展,从而优化治疗,并为新药的设计提供靶点。
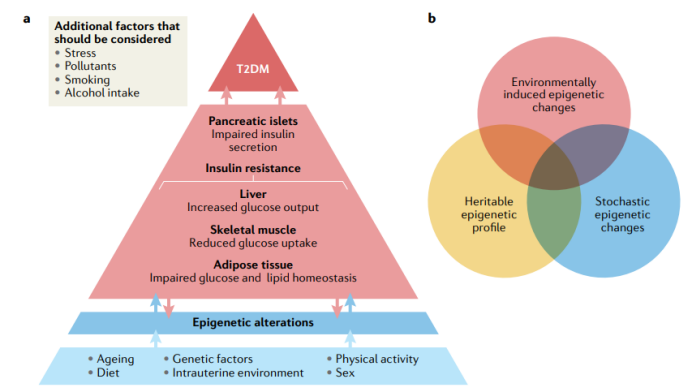
图7 | 表观遗传学在T2DM和肥胖中的作用。a. 人类多个代谢组织参与T2DM和肥胖的发展。在T2DM靶组织(胰腺、肌肉、脂肪组织、肝脏和血液)中,均观察到与疾病和代谢表型相关的表观遗传修饰的改变。如图所示,许多外部因素也与表观遗传修饰有关,如压力、吸烟、接触各种污染物、饮酒等。b. 细胞中的表观遗传修饰可能是遗传的、环境诱发的或随机产生的,也可能是这些因素共同作用的结果。
原文链接:https://www.nature.com/articles/s41574-022-00671-w574-022-00671-whttps://www.nature.com/articles/s41574-022-00671-whttps://www.nature.com/articles/s41574-022-00671-w
关注微信公众号代谢学人
了解更多代谢前沿资讯

转载本文请联系原作者获取授权,同时请注明本文来自徐凌燕科学网博客。
链接地址:https://blog.sciencenet.cn/blog-3483272-1349007.html
