博文
代谢学人--Science子刊:“对不起,我是卧底” — 嵌合外泌体助力肿瘤治疗
||
Science Translational Medicine:
巨噬细胞-肿瘤嵌合外泌体在淋巴结和肿瘤中积累,激活免疫反应和肿瘤微环境

冷风瑟瑟,寒气袭人。
寒风带着新一期的文章来啦~
有一种想念叫望穿秋水,有一种寒冷叫忘穿秋裤

相信北方的宝贝们已经在南方的室内冻的瑟瑟发抖~
上海入冬以后,床以外的地方都是远方,手够不到的地方都是他乡!

这么冷的天,单身狗们应该会升级为旺旺碎碎冰吧
但是!天冷怎么能抑制我们内心熊熊燃烧的科研热情呢

不仅我们在努力着,
巨噬细胞-肿瘤嵌合外泌体也在抑制肿瘤中默默发挥着作用

据说他们通过增强免疫作用和改善肿瘤微环境来抑制肿瘤增殖和迁移

在未来,这或许会给肿瘤治疗带来新的曙光呢

话不多说,让我们一起来看吧!
背景介绍
癌症免疫疗法是一种通过促进或利用身体的免疫系统来对抗肿瘤细胞的手段。许多免疫疗法是基于在体外培养出大量的具有肿瘤细胞识别抗原的效应T细胞,再将这些患者体内原有的T细胞扩增后转移到患者体内,来达到对抗肿瘤的目的。同时,也有一些相类似的癌症疫苗接种技术,其可以在体内触发抗原特异性效应T细胞的产生。然而通过简单地产生或转移大量的癌症特异性T细胞来治疗实体肿瘤往往不够,因为肿瘤微环境(TME)中的免疫抑制状态会降低这些T细胞的渗透和细胞毒性功能。例如,肿瘤相关巨噬细胞
(TAMs)和调节性T细胞(Tregs)产生的免疫抑制细胞因子,如白细胞介素-10 (IL-10)和转化生长因子β(TGF-β),对T细胞在肿瘤内的渗透能力、活性和效应因子的功能均有抑制作用。在这种情况下,一种可以同时增加癌症特异性T细胞生成和调节免疫抑制TME的策略,有望优于仅完成T细胞生成的免疫疗法。
外泌体是由细胞分泌的天然的、纳米级尺寸(直径约30-150nm)的囊泡,这些囊泡内可以囊括许多生物分子(蛋白质、脂质、miRNA等),这些成分反映了分泌该外泌体的细胞的特性。最近的研究表明,通过超速离心收集的巨噬细胞和其他APCs(抗原呈递细胞)细胞上清中的外泌体可以有效地被次级淋巴器官如LNs(淋巴结)中的巨噬细胞和树突细胞所摄取,刺激机体内淋巴结中免疫细胞的激活,这说明外源巨噬细胞的外泌体能够作为疫苗,实现免疫激活,并促进促炎免疫微环境的形成。同时,也有研究表明,由M1型巨噬细胞分泌的外泌体具有将被活化的M2巨噬细胞重新极化为经典活化的M1巨噬细胞的能力(小编注:M1型巨噬细胞通过分泌促炎性细胞因子和趋化因子参与正向免疫应答,促进炎症,发挥免疫监视的功能;而M2型巨噬细胞仅有较弱抗原递呈能力,通过分泌抑制性细胞因子,抑制炎症,发挥组织修复的功能),这有利于改善TME的免疫抑制。
此外,有研究证明,循环的癌细胞具有返回主要肿瘤部位的“归巢”能力,因此,本文作者推测是否可以制备来自于癌细胞和激活的巨噬细胞的嵌合型外泌体,并整合上述独特的功能,以靶向肿瘤组织和改善TME。
Science Translational Medicine近期研究发现,aMT-exos(巨噬细胞-肿瘤嵌合外泌体)可在LNs和实体肿瘤中积累,并随后诱导时空免疫调节抑制癌症。本文证明了生物学重编程的嵌合APC -肿瘤细胞外泌体具有增加T细胞产量和调节肿瘤免疫抑制的双重效应,并阐明了可利用从患者身上获取到的肿瘤特征来制备个性化的免疫刺激纳米级治疗方法。

敲黑板啦!
1、 aMT-exos可在LNs和肿瘤中积累
2、aMT-exos在LNs中驱动免疫应答
3、aMT-exos可改善瘤内注射后TME的免疫抑制
4、aMT-exos靶向肿瘤转移部位,表现出较强的抗转移作用
5、个性化aMT-exos可有效防止术后肿瘤复发
研究结果
1. aMT-exos的合成与表征
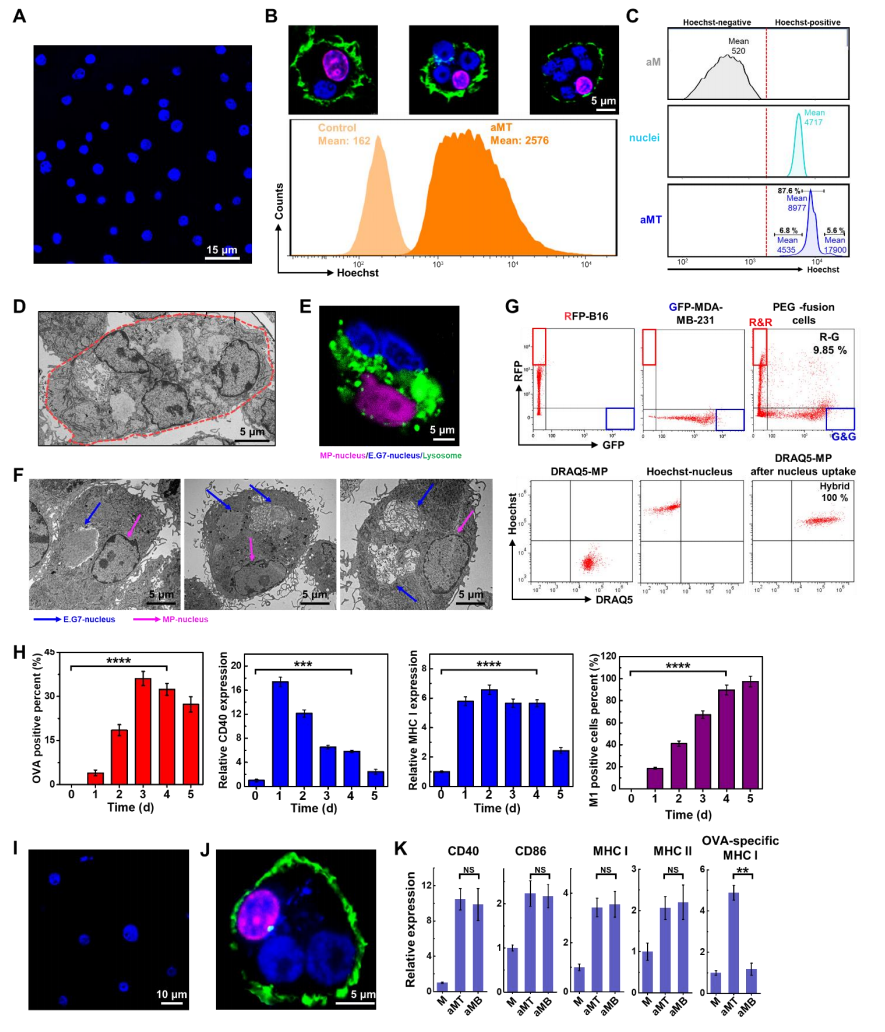
杂交瘤技术中涉及到的融合过程可制备具有整合双亲特性的细胞,而巨噬细胞又有着特殊的吞噬作用。受此启发,作者猜想有可能利用巨噬细胞的吞噬作用来吞噬肿瘤细胞核以制备巨噬-肿瘤杂交细胞。为了证实这一点,作者首先从小鼠腹膜巨噬细胞中提取巨噬细胞,用表达卵清蛋白(OVA)的E.G7淋巴瘤细胞分离的hoechst染色核处理巨噬细胞(图S2A),OVA可用于E.G7肿瘤抗原呈递及特异性免疫活化的分析。在证实E.G7细胞核可被巨噬细胞内化后(图S2B和图S1),作者在巨噬细胞培养基中添加不同剂量的E.G7细胞核,经过不断尝试后发现,当细胞核与巨噬细胞的比值为2 : 1时,巨噬细胞活力维持在95%,肿瘤细胞核内化率达到90%(图1A)。进一步的通过激光共聚焦扫描显微镜、透射电子显微镜(TEM)成像和流式细胞术等分析证实,几乎所有的巨噬细胞都转化为杂交型细胞,一个巨噬细胞通常含有两个肿瘤细胞核(图1B,图S2,图C,图D)。值得注意的是,内化的肿瘤细胞核在接种12小时内没有被运往溶酶体降解,但在第3天时开始被巨噬细胞溶酶体降解(图S2, E和F)。此外,与传统的聚乙二醇诱导的细胞融合相比,通过吞噬外源性细胞核制备巨噬细胞的杂交细胞,可以避免同源细胞融合,获得较好的杂交效能(图S2G)。
为了制备既能表达肿瘤成分,又能释放APCs免疫激活分子的嵌合外泌体,作者用脂多糖(LPS)刺激杂交的巨噬细胞。将LPS与杂交巨噬细胞孵育不同的时间后,作者用流式细胞仪检测肿瘤抗原(以OVA表示)、协同刺激分子(以CD40表示)、主要组织相容性复合体(由MHC I指示)和激活的混合巨噬细胞(aMT)中的经典活化M1巨噬细胞极化指数(由淋巴细胞抗原6复合物(Ly-6C)指示)的表达情况。结果表明:LPS孵育4天后,杂交型巨噬细胞的OVA、CD40、MHC I和Ly-6C的表达显著增加(P < 0.0001)(图1C,S2H)。此外,其他关于协同刺激分子和MHC分子在不同巨噬细胞上表达的前期数据显示:肿瘤细胞核的掺入对协同刺激分子、CD40和CD86、MHC分子、MHC I和MHC II的表达没有影响(图1D)。同时,考虑到肿瘤抗原特异性的MHC分子可能被活化的巨噬细胞自身丰富的MHC分子所掩盖,因此作者进一步使用OVA作为检测肿瘤抗原特异性的指标MHC分子,进行肿瘤抗原检测,结果显示:与aM组相比,aMT组OVA257-264特异性MHC I的表达增加(P < 0.01),这支持了这些细胞在肿瘤细胞核导入后具有较强的肿瘤抗原特异性MHC I表达(图1D)。 此外,bEnd.3内皮细胞作为阴性对照(转入非肿瘤细胞核),随后形成活化的杂交型巨噬细胞bEnd.3(aMB),发现aMB中并没有观察到OVA257-264特异性MHC I的升高(图S2, I,K)。因此,该数据验证了E.G7肿瘤细胞核杂交与OVA257-264特异性MHC I表达之间的高度相关性。
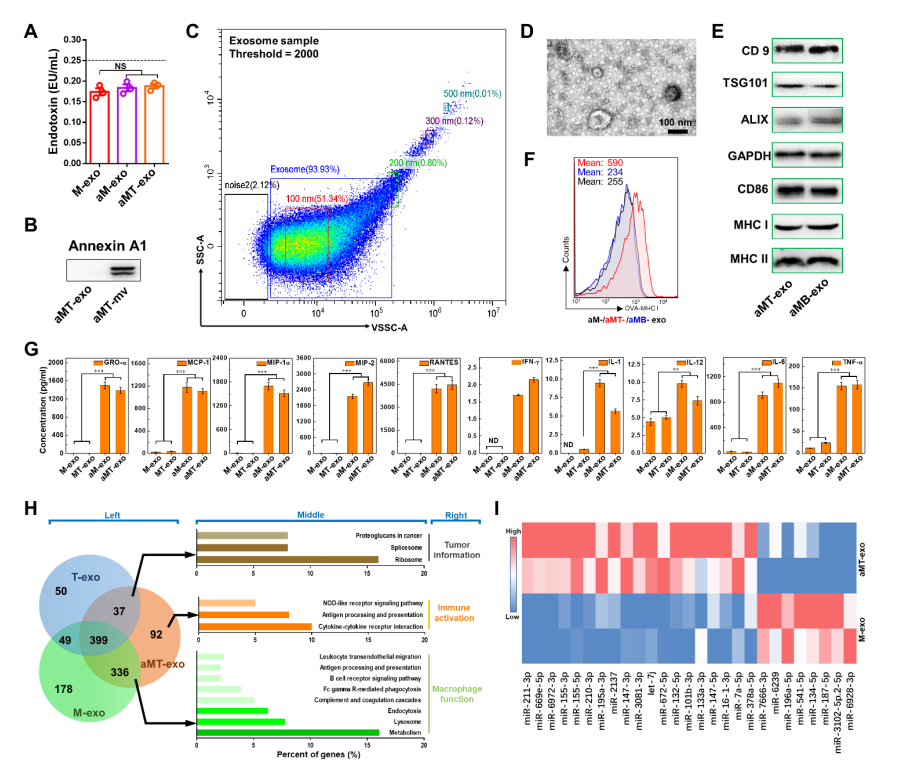
在确认了aMT细胞的多种特性后,作者利用梯度离心和超速离心的方式从LPS和E.G7肿瘤细胞核共孵育第4天的aMT细胞的上清液中分离出其分泌的外泌体(aMT-exos)。在此过程中,为了保证aMT-exos使用的安全性,作者将上清液中的LPS去除(图S3A)。通过TEM图像和纳米颗粒跟踪分析(NTA)技术检测上清液中的aMT-exos,显示出了经典的外泌体杯状形貌,尺寸为30 ~ 150 nm(图1E)。同时,结合外泌体标志物CD9、肿瘤易感基因101蛋白(TSG101)和ALG-2相互作用蛋白X (ALIX)的表达以及annexin A1表达的缺失证实了上清液中的aMT-exos被成功分离(图1F,S3B,S4)。为了进一步评估aMT-exos是否继承了aMT细胞的生物学特性,作者接下来检测了aMT-exos的免疫激活能力和肿瘤相关成分。免疫印迹实验结果显示:aMT-exos中CD86、MHC I和MHC II的蛋白条带比来自非激活态的巨噬细胞-肿瘤杂交细胞(MT-exos)的等量外泌体(图1F)中更加明显(图1F);流式细胞术检测显示,以OVA为代表的肿瘤成分表达会导致细胞样本peak右移,与aM-exos和aMB-exos相比,aMT-exos中OVA257 - 264特异性MHC I表达量更高(图1G,S3, C,F)。这些数据代表着aMT-exos有更强的抗原特异性免疫反应。
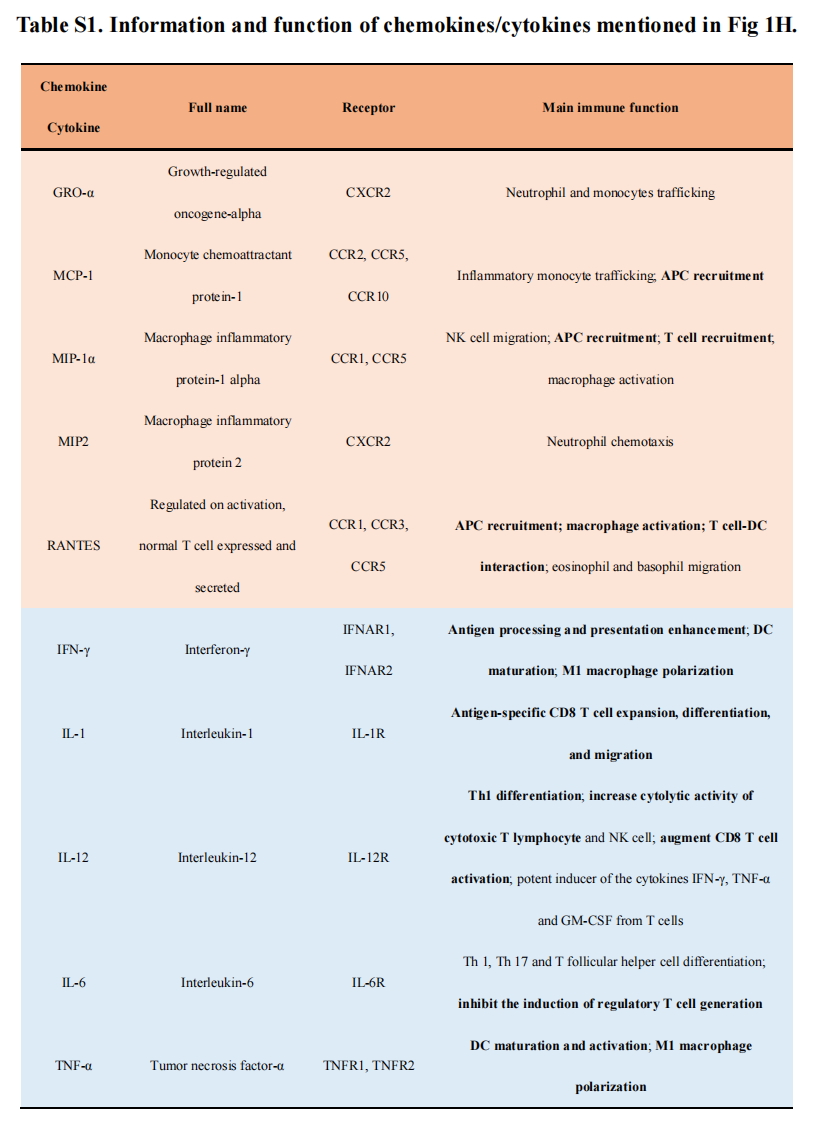
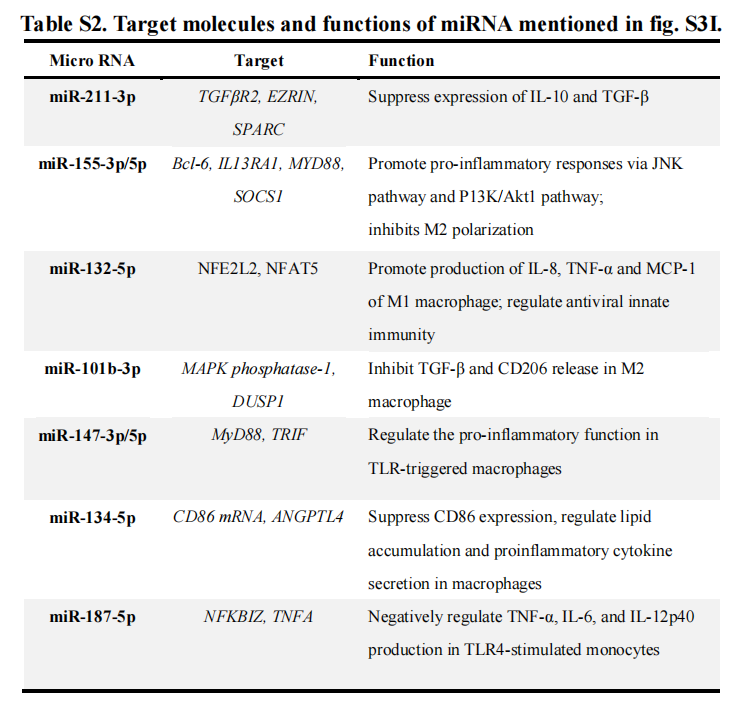
除表面标记物分析外,多重细胞因子分析结果显示:与MT-exos相比,aMT-exos趋化因子数量显著增加(P < 0.01),如生长调节癌基因-α(GRO-α)、单核细胞趋化蛋白-1 (MCP-1)、巨噬细胞炎症蛋白-1a(MIP-1)、MIP-2、正常T细胞表达和分泌(RANTES)和免疫活性细胞因子,如干扰素-(IFN-γ)、IL-1、IL-12、IL-6和肿瘤坏死因子-α(TNF-α)等(图1H和图S3G)。表明aMT-exos可介导免疫激活,如免疫细胞招募、APC激活、T细胞扩张和Treg抑制(表S1)。此外,进一步的蛋白质组学和基因组学分析结果也为aMT-exos的杂交特性和免疫激活潜能提供了更多的证据(图S3,H,I)。例如,microRNA (miRNA)分析显示,aMT-exos和M-exos中有27种miRNA的表达存在差异(图S3I)。在aMT-exos的miRNAs中,许多上调的miRNAs,如miR-211-3p和miR-155-3p,被认为具有免疫刺激潜能,而下调的miRNAs,如miR-187-5p,被认为是免疫抑制介质(表S2)。
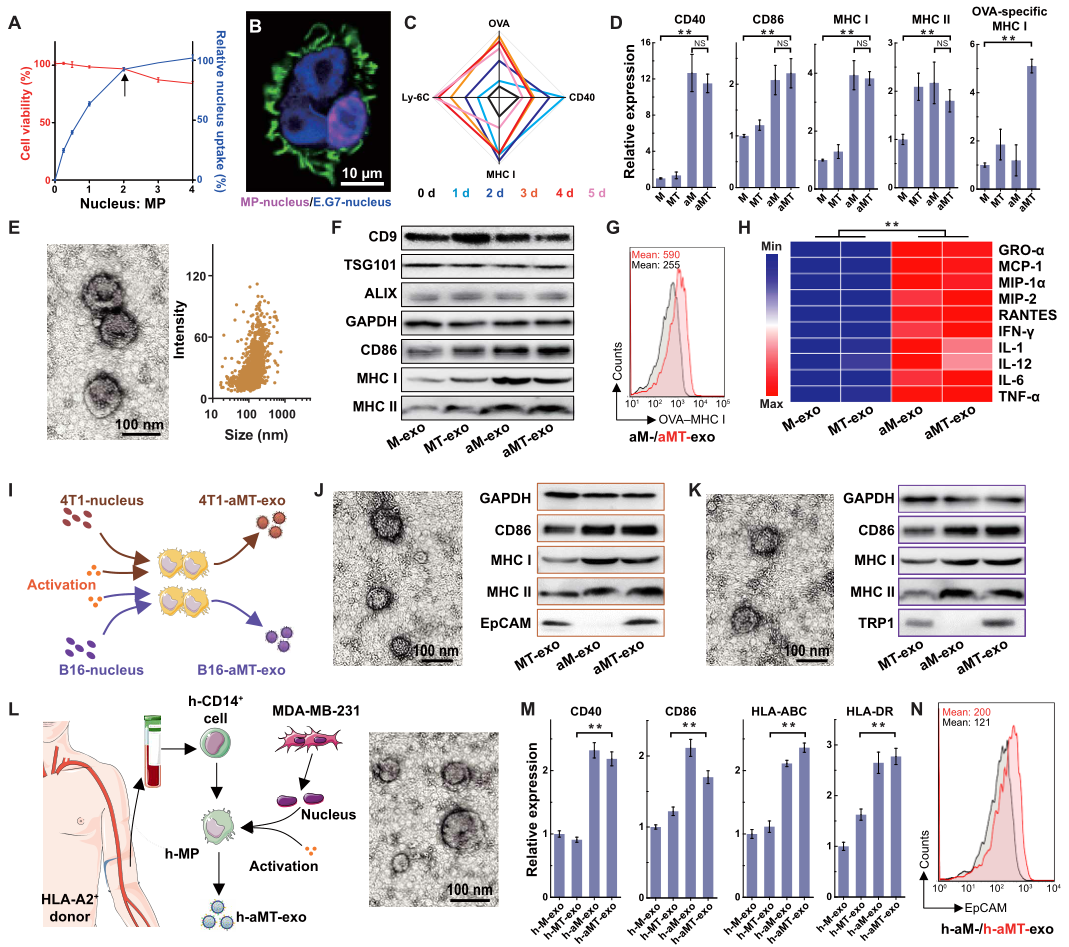
图1.aMT-exos的合成与表征
图S2
图S3
拓展阅读:
杂交瘤技术基本原理
杂交瘤技术是指建立杂交瘤细胞系的技术,其用于产生大量单克隆抗体,所以又称单克隆抗体技术。其是在细胞融合技术上发展起来的:将B淋巴细胞和骨髓细胞融合,即可形成在体外长期存活并分泌免疫蛋白的杂交瘤细胞。通过克隆化可得到来自单个杂交瘤细胞的单克隆系,即杂交瘤细胞系,它所产生的抗体是针对同一抗原结合位点的抗体,即单克隆抗体(monoclonal antibody),简称单抗。单克隆抗体具有高度专一性,一种单克隆抗体只能识别一种特定的抗原决定簇。正是由于其特异性强,因此被广泛应用于生物学,药学,医学等领域,具有极其远大的应用前景,因此用于制备单克隆抗体的杂交瘤技术也变得越来越重要。
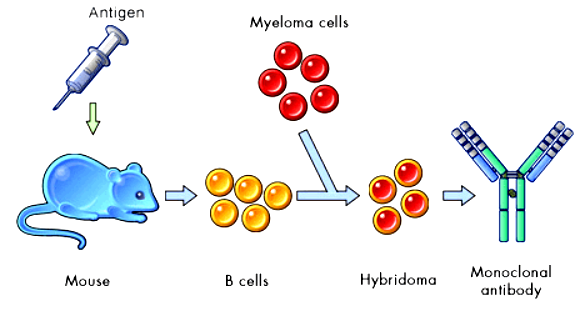
图:杂交瘤技术
杂交瘤技术基于三种关键技术:
一、动物免疫
将特定的抗原注射到哺乳动物(如小鼠)体内,在外来抗原刺激下,被免疫动物脾脏内的B淋巴细胞大量增殖并且分泌针对于该抗原的特异性抗体。动物免疫的作用就是用特定外来抗原对动物进行免疫,以刺激能分泌特异性抗体的B淋巴细胞大量增殖。
二、细胞融合
B淋巴细胞受外来抗原刺激后可以分泌抗体,但B淋巴细胞本身是一种终末分化细胞,通常不再进行细胞分裂,存活一段时间(最多两周)便死亡;而骨髓瘤细胞不分泌抗体,却能在体外无限增殖存活。如果能将这两种细胞的特性结合起来,就能得到既能分泌抗体又能在体外长期存活的细胞,细胞融合杂交瘤细胞中非常关键的一个步骤。
细胞融合的过程包括两个原生质体的接触、粘连、膜融合、细胞质融合,进而两个核同步分裂发生核融合,可分为同源融合和异源融合两类。同源融合是指同一物种细胞在原生质体分离过程中,常自发融合,故称自发的同源融合。异源融合是指不同物种原生质体在融合诱导剂或电场的作用下发生的融合,又称诱导融合。
过去使用NaNO3、仙台病毒、人造海水等作为融合诱导剂,融合频率极低。1973年Keller和Melchers首次用高Ca2+、高pH诱导融合,融合频率大大提高。1974年高国楠和Mi-chayluk首先报告用PEG(聚乙二醇)诱导融合。PEG分子能改变各类细胞的生物膜结构,使两细胞接触点处质膜的脂类分子发生疏散和重组,由于两细胞接口处双分子层质膜的相互亲和以及彼此的表面张力作用,从而使细胞发生融合,形成杂种细胞。PEG具有强烈的吸水性以及凝聚和沉淀蛋白质的作用,能够有效地促进植物细胞以及动物细胞的融合。
三、杂交瘤细胞筛选
筛选杂交瘤细胞一般使用HAT培养基(HAT培养基成分:含有次黄嘌呤(H)、氨基喋呤(A)和胸腺嘧啶(T)三种成分),原理是:(1)经融合后细胞将以多种形式出现:融合的B细胞-瘤细胞、融合的B细胞-B细胞、融合的瘤细胞-瘤细胞、未融合的B细胞、未融合的瘤细胞以及细胞的多聚体形式等。正常的B细胞在培养基中存活仅5~7天,无需特别筛选,细胞的多聚体形式也容易死去。而未融合的瘤细胞则需进行特别的筛选去除。(2)融合所用的瘤细胞是经毒性培养基选出的中间合成途径缺失株,例如嘌呤的中间合成途径缺失株和嘧啶的中间合成途径缺失株,即只有起始合成途径。效应B细胞虽不增殖,但有两条DNA合成途径。(3)氨基蝶呤是叶酸的拮抗剂,可阻碍起始合成途径。HAT培养基中含有氨基蝶呤时,细胞只有中间合成途径,所以必须供给核苷酸。杂交瘤细胞的起始合成途径被氨基喋呤阻断,但可通过中间合成途径利用以培养基中次黄嘌呤和胸腺嘧啶脱氧核苷为原料进行合成。而缺失中间合成途径的瘤细胞,失去增殖能力。从而选择出杂交瘤细胞。最后采用体内或者体外方式对筛选的能分泌特异性抗体的杂交瘤细胞进行扩大培养,最后收集提纯获取单抗。
2. 将aMT-exos技术扩展到其他类型和种类的肿瘤细胞中
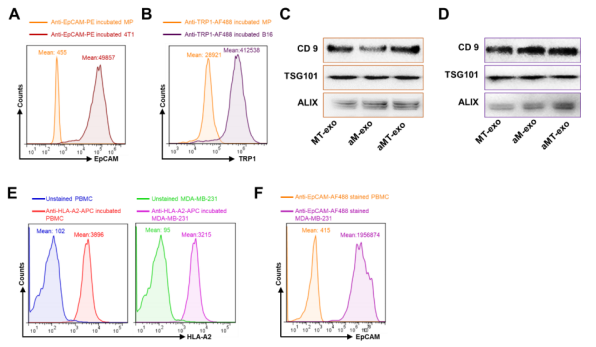
为了检测其他类型的肿瘤细胞能否构建出aMT-exos,并展现出相同的免疫激活和肿瘤成分表达的潜力,作者制备了另外两种类型的杂交细胞:将激活的巨噬细胞与4T1三阴性乳腺癌细胞核和B16黑色素瘤细胞核相孵育,并从这些杂交细胞中分离出外泌体(4T1-aMT-exos和B16-aMT-exos)(图1I)。通过检测发现,两种分离的外泌体均表现出与前面提到的E.G7-aMT-exos相同的形态、大小,以及类似免疫激活分子的高表达(包括CD86、MHC I和MHC II)(图1,J,K)。此外,在4T1-aMT-exos和B16- amt -exos中分别检测到了肿瘤上皮细胞粘附分子(EpCAM,在4T1中表达)和酪氨酸酶相关蛋白1(TRP1,在B16中表达)的表达(图1,J,K,图S5:A-D),该结果反映了嵌合型外泌体成功的表达了相关的肿瘤成分。
为了确保小鼠层面的aMT-exos开发工作与临床上的相关性,作者评估了人aMT-exos(h-aMT-exos)是否可以用人源细胞来生产。作者首先从健康供体(人白细胞抗原A2阳性型血液)中提取人外周血单核细胞(PBMCs)(图S5E)。
接着,作者又进一步地从体外分化的巨噬细胞中分离出CD14 +单核细胞。这些分化的巨噬细胞随后被激活,同时与培养的人三阴性乳腺癌细胞株MDA-MB-231(HLA-A2+)的细胞核孵育(图S5E)。孵育4天后,作者成功从杂交细胞上清中分离出杯状形貌的h-aMT-exos(图1L)。与小鼠aMT exos的结果相似,被激活的巨噬细胞的外泌体(h-aM-exos和h-aMT-exos)与灭活巨噬细胞外泌体(h-M-exos和h-MT-exos)相比,显示出了2 - 3倍的共刺激分子CD40和CD86,以及MHC分子(HLA-ABC和HLA-DR)的高表达(P < 0.01)(图1M)。同时,与h-aM-exos相比,MDA-MB-231肿瘤相关抗原(EpCAM)在h-aMT-exos中表达(图1N和图S5F)。这些结果均表明,同时具有免疫激活和肿瘤特性的嵌合型人源h-aMT-exos可以被成功制备,也证实了该项外泌体技术从小鼠推广到人类的可行性。
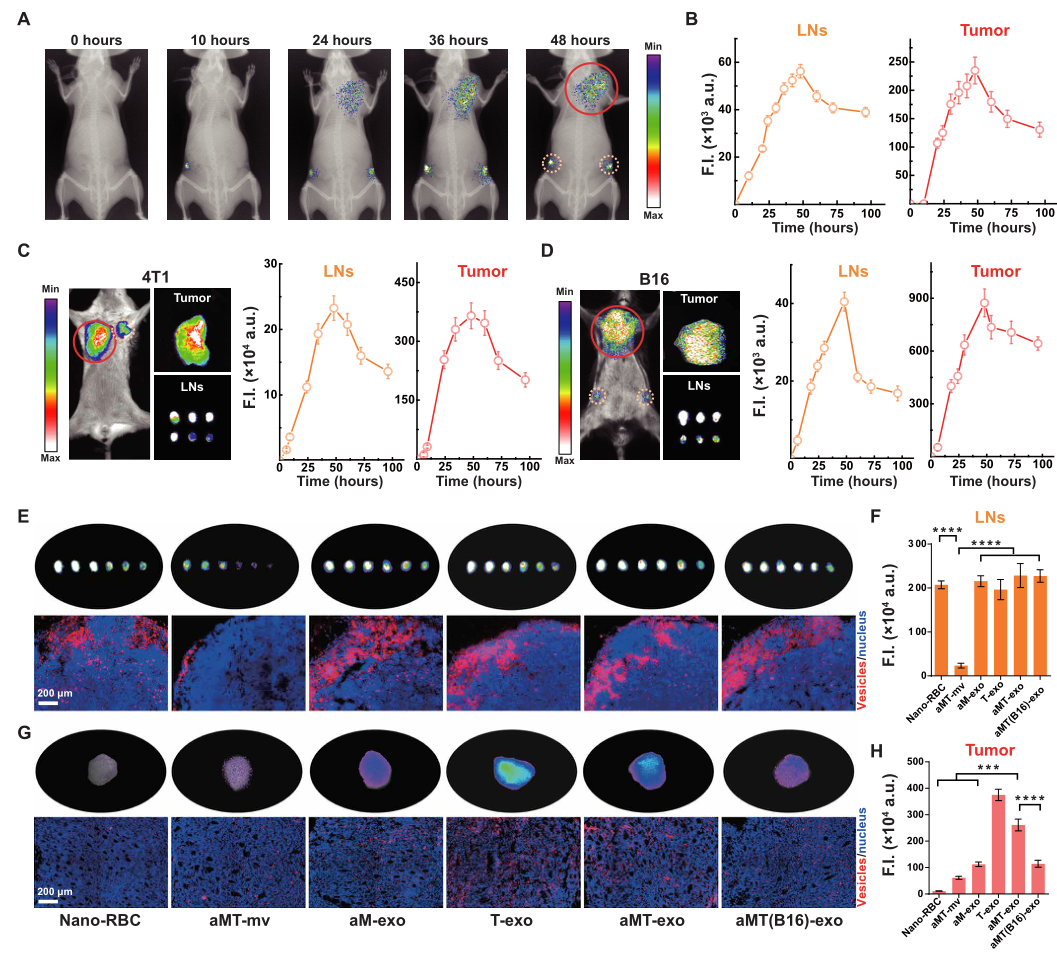
图2.将aMT-exos技术扩展到其他类型和种类的肿瘤细胞中
图S5
拓展阅读:
巨噬细胞的抗原呈递
抗原呈递细胞(APC)包括巨噬细胞和树突细胞,其激活免疫反应的过程可大致分为抗原摄取、抗原处理、抗原呈递三个阶段。
一、抗原摄取
非已抗原(如细菌抗原或可溶性抗原)以非特异性方式与巨噬细胞结合,后者借助吞噬、胞饮、吸附等作用摄取抗原。这个过程也称为抗原的内吞。
二、抗原加工
抗原加工是体内细胞收集抗原,并将其降解为肽段的过程(注:肿瘤细胞表达抗原具有特异性,故在巨噬细胞内形成的肽段具有肿瘤特异性,巨噬细胞表面表达的MHC具有特异性)。T细胞通常不能识别天然蛋白抗原的决定簇。被APC摄入的天然抗原须在胞内通过代谢而修饰成能与MHC-Ⅱ类分子结合的、具有强免疫原性的肽段。在人体,几乎所有的细胞(除了红细胞)表面均表达主要组织兼容复合体(MHC),这是一种能与肽段结合的蛋白复合物,通过呈递抗原肽向T细胞反馈。
三、抗原呈递
抗原呈递是将处理过的抗原肽段展示到细胞表面,从而便于T细胞识别的过程。表达于巨噬细胞表面的多肽-MHC-Ⅱ分子复合物被呈递给辅助性T细胞(TH细胞)。TH细胞表面的CD4分子参与刺激信号的传递并介导T细胞产生淋巴因子并发挥效应功能。
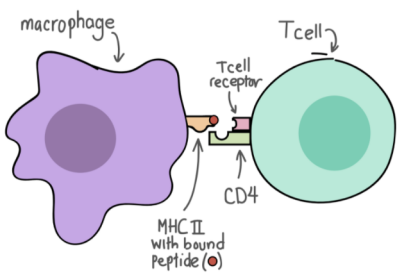
巨噬细胞的抗原呈递
(人人学懂免疫学:第十八期 | 免疫学专题插图)
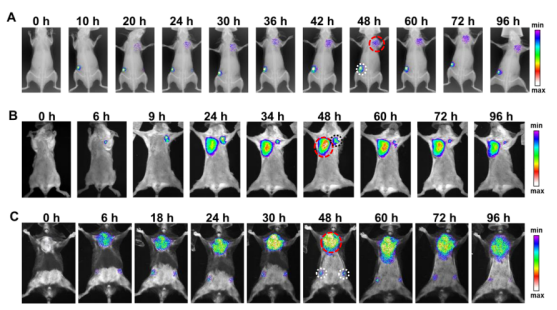
为了检测aMT-exos能否在LNs和肿瘤组织中实现双重积累,作者在aMT-exos上装载了荧光染料(碘化胺,DiR),然后将DiR-aMT-exos皮下注射于E.G7荷瘤小鼠背部。通过注射后不同时间点荧光信号分布的体内成像结果显示,DiR信号在腹股沟LNs和肿瘤处逐渐积累(图2A)。定量数据显示,在48h时,在两个LNs和肿瘤组织中都观察到了高强度的荧光(图2B,S6A)。接下来,作者研究了这种双靶向能力在其他肿瘤类型的嵌合外泌体中是否也能同样实现。首先,作者将4T1-aMT-exos和B16-aMT-exos分别皮下注射到相应的4T1荷瘤和B16荷瘤小鼠体内,在两种实验环境下均观察到同样的双重积累现象(图2C,D,图S6, B,C)。这些结果表明:这种嵌合aMT-exos双重积累在多种肿瘤类型中能够广泛适用。(小编注:肿瘤免疫疗法可以调动机体自身的免疫细胞识别杀伤肿瘤,是极具潜力的肿瘤治疗新策略。现有的大部分免疫治疗侧重于提升免疫细胞功能和数量,但通常难以克服实体肿瘤部位的免疫抑制微坏境,使得瘤内浸润的免疫细胞难以有效发挥其抗肿瘤功能。淋巴结-肿瘤双靶向型外泌体可以用于双效协同肿瘤免疫治疗。在LNs和肿瘤中均出现积累也说明这种免疫细胞外泌体具有免疫激活作用和肿瘤细胞的归巢现象。)
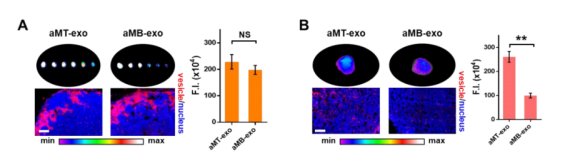
为了进一步确定影响aMT-exo在LNs和肿瘤组织内积累的因素;同时考虑到aMT-exos的尺寸和肿瘤成分含量有可能影响到其在不同组织中的积累能力,作者利用荧光染料DiR对不同类型细胞囊泡进行标记:比较了由红细胞(nano- RBC)制备的纳米级囊泡和杂交巨噬细胞分泌的微米级囊泡(aMT-mv)、活性巨噬细胞外泌体(aM-exo)、E.G7肿瘤细胞外泌体(T-exo)、、等基因E.G7核源性外泌体(aMT-exos)、异质B16核源性aMT外泌体(aMT(B16)-exos)和异质bEnd .3核源性(aMB-exos),结果显示:aMT-mv在LNs中聚集的含量较低,而相比之下另外6种纳米级的囊泡在LNs内的积累增加了近7倍(P < 0.0001),这表明外泌体纳米级尺寸的特征会影响其在组织中的积累能力。(图2E,F,S7A)。对于E.G7肿瘤的靶向性,作者观察到T-exos比nano- RBC和aM-exos表现出更高的E.G7肿瘤富集(P < 0.0001),进而排除了单纯物理大小的影响,提示外泌体归巢的发生是由于肿瘤成分所致。考虑到aMT-exos同时具有来自巨噬细胞和E.G7肿瘤细胞的嵌合体成分,并且作者观察到aMT-exos在肿瘤中的富集程度显著高于aM-exos(P < 0.001)(图2G),作者猜想这些外泌体在一定程度上继承了其亲本杂交细胞的肿瘤归巢能力。此外,aMT(B16)-exos和aMB-exos在E.G7肿瘤组织的积累显著(P < 0.01)低于aMT-exos(图2、G、H和图S7B),证实了E.G7肿瘤特异性活性靶向能力与aMT-exos中的肿瘤同源性成分呈正相关,该外泌体靶向积累结果均得到了LNs和肿瘤切片组织学分析数据的支持(图2,E,G)。
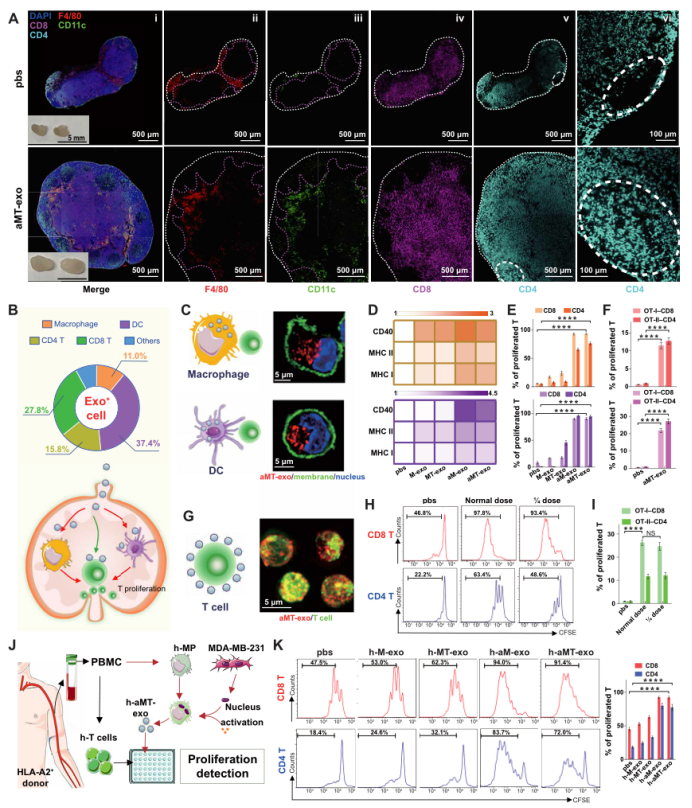
图3.在LNs和肿瘤中均有aMT-exos积累
图S6
图S7
拓展阅读:
干细胞归巢效应
无论是“骨髓移植”(造血干细胞移植),还是静脉回输间充质干细胞,干细胞在体内都需要运输,需要被调动到受伤的组织周围发挥功能。因此,干细胞需要一个帮它导航定位的“GPS”,而这种能力就是干细胞的“归巢效应”。干细胞正确的“归巢”,即不用外力刻意,干细胞可以从自己的家出来在外周血中“溜达”一圈,再寻找到并进入微环境适宜的“niche”中并定居其中,安居乐业,这就是我们说的“归巢”。
“归巢”(homing)最早是指循环在血液中的淋巴细胞倾向于迁移到它们原先派生自那里的淋巴细胞部位,如淋巴结,这一回归现象称为“淋巴细胞的归巢”,这是1983年Gallation提出来的。干细胞归巢就是指自体或外源性干细胞在多种因素的作用下,能定向趋向性迁移,越过血管内皮细胞至靶向组织,并定植存活的过程,类似于人体局部炎症反应后大量白细胞迁移至炎症周围。干细胞的归巢能力就像自带了GPS,通过定位系统自动导航去身体需要它的地方,及时修复受损细胞。
2018年Nature发表了干细胞“归巢”的全过程,并找到了影响干细胞归巢的关键因素,先导细胞。在斑马鱼胚胎中,在心脏泵出的血液冲刷下,干细胞在主动脉血管壁侧壁诞生了。它循着血液在体内流转,当它经过尾部造血组织时,血管内皮细胞上的粘附分子使高速奔流的干细胞降速,减速之后的干细胞来到血管遇到带有血管细胞粘附分子VCAM-1的“先导细胞”。与干细胞ITGA4结合,将干细胞带到附近的静脉微血管中,在需要干细胞的地方发挥功能。
肿瘤干细胞的转移与归巢和肿瘤转移的步骤基本相似,肿瘤的转移可以形象地称为肿瘤干细胞的“归巢”。肿瘤干细胞脱离原发病灶,外渗到细胞外基质,促进血管的生成或细胞内渗,从而进入循环系统,逃避宿主的防御机制,通过趋化作用迁移到特定的血管位点,黏附,然后再外渗出血管而归巢到特定的微环境,形成转移灶。
参考文献:
Li D, et al. Nature. 2018 Dec;564(7734):119-124.
4. aMT-exos在LNs中驱动免疫应答
为了评估aMT-exos是否能在LNs内发挥免疫刺激功能,作者将小鼠腹股沟LNs分离,并进行石蜡包埋与染色。与PBS处理组相比,经aMT-exos处理的LNs体积更大,且含有更多的免疫细胞(图3A)。定量分析显示,经aMT-exos处理后的LNs中APCs、巨噬细胞和树突状细胞(DCs)的数量增加了约4倍(P < 0.0001);并且与PBS处理的对照组相比,经aMT-exos处理后,LNs体积增加了约3倍(P < 0.001)(图S8, A,B)。此外,作者还注意到这些富集的APCs可渗透到皮质旁T细胞区(图3A, ii和iii),表明LNs潜在的T细胞激活状态,且LN与对照组相比,CD8 T细胞和CD4T细胞在经aMT-exos处理后增殖潜力升高(P < 0.01)(图S8C),细胞数量增加3 ~ 4倍(P < 0.001)(图3A、iv、v和图S8D),以及观察到CD4 T向炎症中心迁移的现象(图3A, vi)。以上数据表明,aMT-exos可以激活细胞和体液免疫反应。
考虑到LNs对aMT-exos浸润的免疫刺激作用,作者进一步探索了可能的免疫应答激活途径,发现APCs和T细胞共占了aMT-exos阳性免疫细胞的90%以上(图3B:巨噬细胞11.0%,DC 37.4%, CD4 T 15.8%, CD8 T 27.8%)。作者通过用荧光染料DiD标记aMT-exos,检测aMT-exos能否被巨噬细胞和树突细胞(DCs)内化:用DiD-aMT-exos培养巨噬细胞和DCs。孵育12小时后,结构照明显微镜图像和三维(3D)重建图像结果显示DiD-aMT-exos确实能够被巨噬细胞和DCs吸收(图3C,S9A,S2,S3)。内化的aMT-exos进一步诱导两种APCs中的协同刺激分子CD40和MHC分子MHC I和MHC II的表达(图3D,S9B)。为了测试这些aMT-exos激活的APCs能否刺激T细胞增殖,作者将来自WT小鼠的羧基荧光素琥珀酰亚胺酯(CFSE)染色的脾脏细胞与aMT-exos处理的APCs共培养。72 h后,aMT-exos-APCs处理的CD8 T细胞和CD4 T细胞增殖率显著高于PBS处理的对照组APCs(P < 0.0001)(图3E,S9C)。通过体外培养扩增的卵清蛋白转基因小鼠(OT-I和OT-II)的脾脏细胞,发现了肿瘤抗原刺激下的T细胞激活,进一步证明了aMT-exos包含了肿瘤特异性抗原的成分,并能够激活T细胞(图3F,S9D) 。相比于诱导E.G7抗原缺失的exo组(如aM-exos和aMT(B16)-exos)来讲,aMT-exos组刺激产生的肿瘤特异性T细胞才能够抑制E.G7肿瘤(图S9, E和F)。除了这些经典的免疫刺激作用,作者在先前的研究中发现,CD8和CD4 T细胞可与aMT-exos相互作用(图3B)。这些结果显示,这些嵌合外泌体可以表达协同刺因子激CD86和MHC分子,表明这些外泌体可能作为纳米级别的APCs对T细胞发挥直接免疫刺激作用。为了证明这一点,作者将荧光染料DiD标记aMT-exos,将其添加到CFSE-标记的T细胞的培养基中。12h后,作者观察到aMT-exos位于T细胞表面的强信号(图3G,图S10A,S4)。在aMT-exos上的共刺激因子和MHC分子的协同刺激下,作者分析了aMT-exos作用72h后CFSE T细胞的增殖情况,结果表明:aMT-exos刺激后,WT小鼠和OT-I或OT-II小鼠的CD8 T细胞和CD4 T细胞增殖率增加了两倍以上(P < 0.001)(图3,H,I和图S10C)。这种抗原特异性T细胞增殖也在经历了DCs缺失、巨噬细胞缺失和DC巨噬细胞双重缺失的小鼠模型中观察到(图S10, D-F),这一结果再次证实了所提出的纳米APC的想法。因此,当使用aMT-exos而不是使用不含E.G7抗原的外泌体组时,才能够观察到E.G7细胞的免疫活性(图S10, G和H)。此外,当将剂量减少到前一次使用的25%时,aMT-exos仍然能够增加T细胞增殖并抑制E.G7肿瘤,这显示了外泌体介导的直接免疫刺激的有效性(图3,H,I,和图S10G)。根据这一现象,作者推测这种高效率的作用可能部分归因于外泌体的纳米尺寸,使得许多aMT-exos能够与单个T细胞相互作用。
作者也观察到这种外泌体能够诱导人类T细胞的直接激活。用MDA-MB-231的细胞核制备肿瘤细胞和巨噬细胞来自匹配的健康供体的PBMCs的h- aMT-exos。h-T细胞也从相同匹配的供体的PMCS中分离出来,培养后可用于后续实验(图3J)。与PBS组(对照组)相比,经活化巨噬细胞来源的外泌体处理后,人T细胞增殖显著增加(P < 0.0001)(图3K)。同时,考虑到h-aM-exos组和h-aMT-exos组的T细胞增殖程度相当,作者进一步比较了h-aM-exos组对MDA-MB-231细胞的肿瘤免疫作用,来验证T细胞增殖是否具有肿瘤抗原特异性。结果显示,与预期相符,h-aMT-exos组比h-aM-exos组对于肿瘤抑制的效果更好(P < 0.0001) (图S10I),说明h-aMT-exos可诱导肿瘤抗原特异性T细胞增殖。
拓展阅读:
APC
APC(antigen-presenting cells),即抗原呈递细胞,是指在免疫反应过程中,能将抗原物质呈递给T细胞的一类辅佐细胞。APC是一群异质性细胞,白细胞中主要有单核-巨噬细胞和树突状细胞,一些非白细胞在细胞因子的影响下,也可提呈细胞的功能(如内皮细胞等)。其细胞表面的MHC分子可以和抗原结合。T细胞可以识别这些MHC分子和抗原的复合体。
除了APC之外,机体其他细胞在特殊情况下也可呈递抗原。抗原呈递细胞(如巨噬细胞、B细胞和树突状细胞)可将外源性抗原呈递给辅助性T细胞;此外,病毒感染的细胞(或癌细胞)也可以将源自细胞内的抗原呈递给细胞毒性T细胞。
APC对于有效的适应性免疫反应至关重要,因为细胞毒性和辅助性T细胞的功能均依赖于APC。抗原呈递允许适应性免疫的特异性,并且可以促进针对细胞内和细胞外病原体的免疫应答。
本文中,嵌合外泌体配备了各种免疫成分,如MHC-I分子、共刺激分子和免疫激活的细胞因子,借助其纳米尺寸和肿瘤归巢分子,这些嵌合外泌体可以流入淋巴结并聚集到实体瘤。在淋巴结内,aMT-exos以经典的抗原呈递细胞介导的方式和独特的“直接的外泌体相互作用”方式诱导了T细胞激活。在肿瘤内,aMT-exos改善了免疫抑制性的肿瘤微环境。这种免疫反应和肿瘤微环境的共同激活使原发性肿瘤、肿瘤转移和术后肿瘤复发受到有效抑制,从而实现个性化免疫治疗。
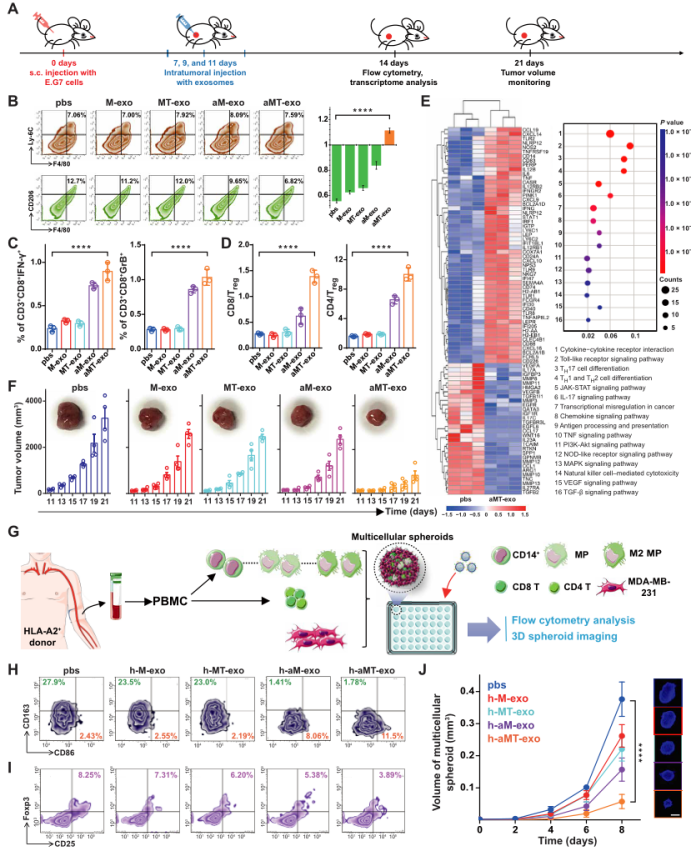
图4.aMT-exos在LNs中驱动免疫应答
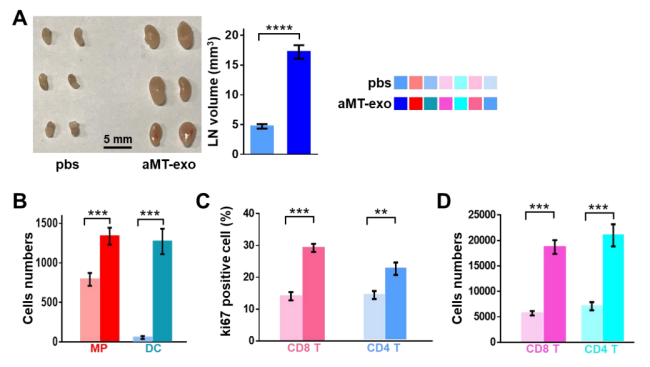
图S8
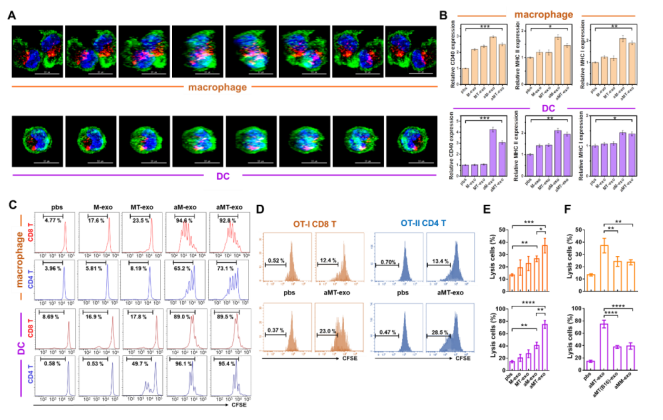
图S9
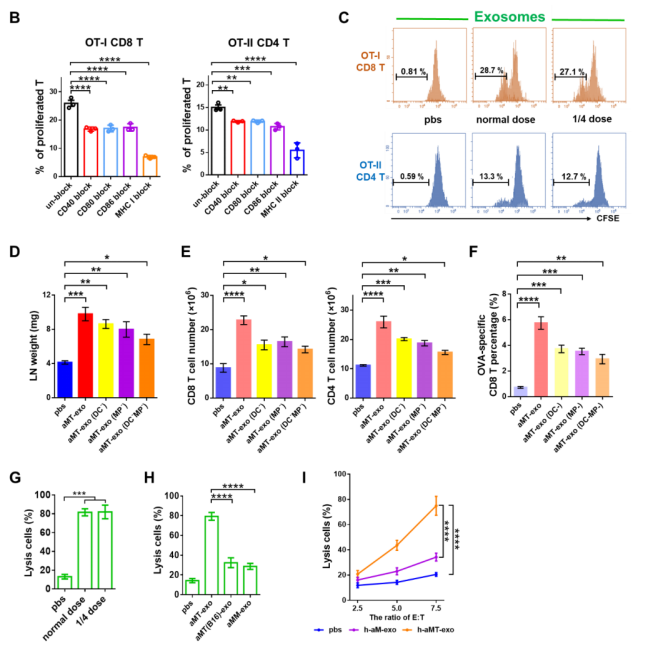
图S10
5. aMT-exos可改善瘤内注射后TME的免疫抑制
为了检验嵌合外泌体对TME的直接影响,作者通过将每种外泌体瘤内注射(为了尽量减少LN或系统免疫激活对TME的影响)到不同的E.G7实体荷瘤小鼠中来测试各种类型的外泌体的功能(图4A)。进行三次注射周期后,作者发现aM-exos治疗的肿瘤M1极化TAMs与M2极化TAMs的比值出现了明显的逆转(M1/M2 > 1)(图4B)。而IL-4处理的巨噬细胞与aMT-exos体外孵育后也发现了类似的巨噬细胞极化(图S11A)。因此,作者推测肿瘤巨噬细胞向M1表型的这种极化可能是由于aMT-exos是由M1巨噬细胞制备的。
同时,作者还发现瘤内注射aMT-exos引起细胞毒性T淋巴细胞(CD3+,IFN-γ+,CD3 +,CD8 +,Granzyme)比例的增加(P < 0.0001)(图4C和图S11B)。此外,CD8 T细胞(CD3+CD8 +)或CD4 T细胞(CD3 +CD4 +)转化为Treg (CD3+CD4 +CD25 +Foxp3 +)在aMT-exos注射后的肿瘤中增加(图4D;P < 0.0001),这可能与肿瘤内源性T细胞表型的改变有关,而非外周循环浸润性T细胞的迁移所致(图S11, C-F)。
接下来,作者对这些瘤内注射各种外泌体的荷瘤小鼠的肿瘤进行了转录组测序(图S11G)。结果发现,aMT-exos处理的肿瘤中,许多免疫激活相关基因表达量增加(如CCL19、CXCL9、CD40和TLR9),而免疫抑制基因表达量降低(如CCL1、TGFB2、ARG1和TCAIM,以及癌症促进因子,如MMP10, RTKN和VEGFA)。此外,KEGG通路分析揭示了主要激活通路:toll样受体信号通路、TNF信号通路、趋化因子信号通路(图4E)。总之,这些结果表明,aMT-exos直接处理肿瘤增加了TME中的免疫活性成分,而减少了免疫抑制成分,最终显著抑制了肿瘤的发展(P < 0.01)(图4F,S11, H和I)。为了评估h- aMT-exos在人类肿瘤中的免疫调节作用,作者将人PBMCs衍生的T细胞和极化的M2巨噬细胞与MDA-MB-231细胞在琼脂糖凝胶附着的96微孔板中共培养(图4G)。7天后,作者使用孔板中形成的三维多细胞球体来代表人体内的TME,从而进一步进行各种外泌体类型的免疫调节实验。结果显示,h-aMT-exos处理仍然比h-M-exos处理更有效,导致M1样巨噬细胞的增加(从h-M-exos对照组的2.55%增加到11.5%,P < 0.0001)和M2样巨噬细胞的减少(从23.5%的h-M-exos对照组到1.78%, P < 0.0001)(图4H和图S11J)。此外,在h-aMT-exos治疗组中,3D多细胞球体中Treg的减少超过2倍(P < 0.0001)(图4I和图S11K)。总的来说,这些h-aMT-exos可诱导TME的变化,导致3D肿瘤球体的生长受到显著抑制(P < 0.0001)(图4J和图S11L),证明了h-aMT-exos在人类肿瘤中调节TME的潜力。
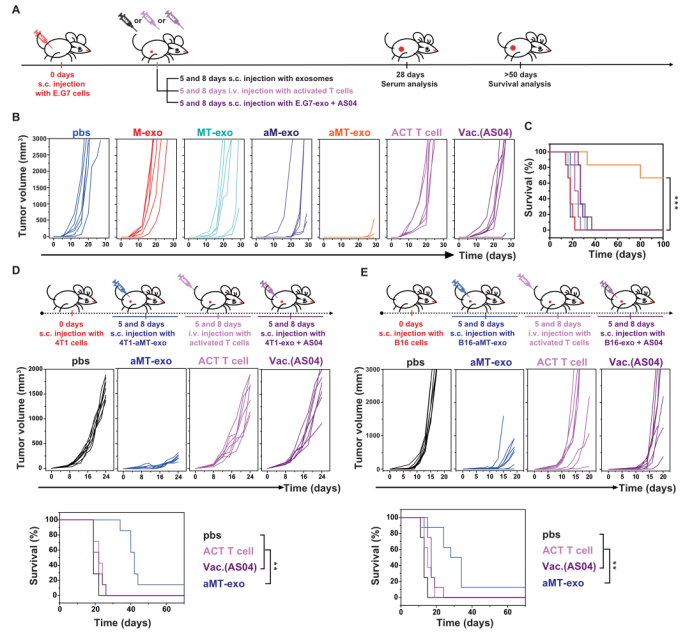
图5.aMT-exos可改善瘤内注射后TME的免疫抑制
图S11
在综合验证了aMT-exos的生物安全性后(图S12),作者对E.G7原发肿瘤进行了进一步的探究:aMT-exos的时空免疫调节策略是否可以促进抗肿瘤作用。作者将E.G7荷瘤小鼠皮下接种各种类型的外泌体(第5天和第8天)、AS04和肿瘤外泌体混合物(第5天和第8天),以及静脉注射体外激活的T细胞(第5天和第8天)(图5)。作者通过记录肿瘤生长情况,发现对照组和M-exos组并没有明显差异,但观察到MT-exos处理的小鼠中6例中有2例肿瘤生长延迟,aMT-exos处理的小鼠中6例中有5例肿瘤生长延迟。同时,与aM-exos组产生抗原非特异性T细胞和肿瘤积累不良的情况相比,aMT-exos组可以实现抗原特异性T细胞激活和改善TME。实验结束时,4只接受aMT-exos的小鼠无肿瘤(图5B)。值得注意的是,作者也采用了E.G7抗原缺失的外泌体(如aMT(B16)-exos和aMB-exos)来治疗荷瘤小鼠,并观察到与aMT-exos相比,其肿瘤的抑制效果较低(P < 0.001)(图S13)。这进一步证明了具有肿瘤特性的肿瘤核杂交策略对有效治疗结果的重要性。除了各种外泌体类型,传统的过继细胞转移治疗(ACT T细胞)和疫苗接种治疗(AS04和肿瘤外泌体)也被用于比较。配方疫苗接种组称为Vac (AS04)。这两组的抗肿瘤效果较差,说明TME阻碍了传统免疫刺激疗法产生的效应细胞的有效杀伤能力。此外,作者发现上述组别的肿瘤大小与生存和血清生化指标相关(图5C和图S14A),值得注意的是,只有经过aMT-exos处理的小鼠能活过40天(66%的aMT-exos处理的小鼠在100天仍然存活)。除了E.G7外,作者还制备了来自其他肿瘤类型的嵌合外泌体,并测试了其对小鼠同种或异种肿瘤的疗效。结果发现,与PBS对照组相、ACT T细胞组和Vac.(AS04)组相比,4T1-aMT-exos -和B16 -aMT-exos处理的小鼠均表现出显著(P < 0.01)的抗肿瘤作用(图5,D和E,图S14, B和C),再次显示了aMT-exos强有力的抗肿瘤作用。
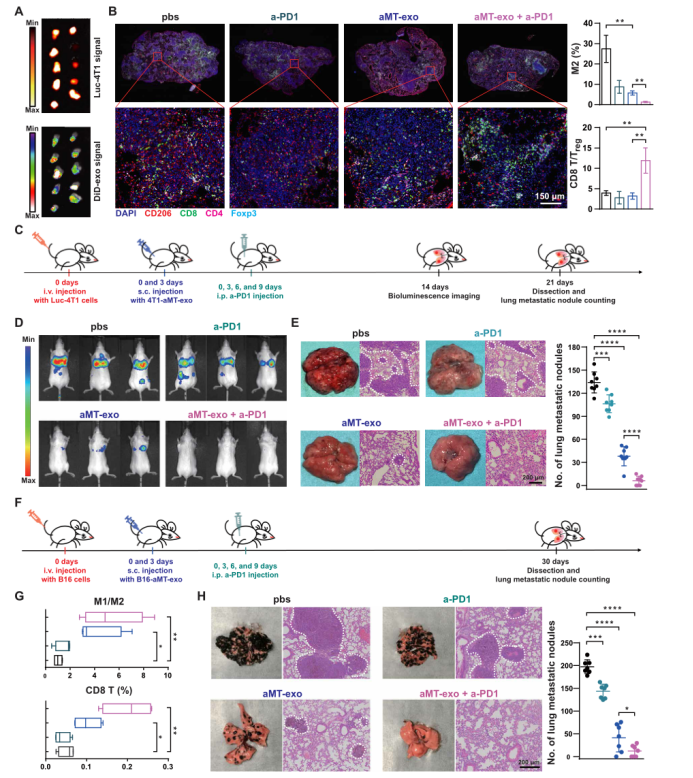
图6. aMT-exos可改善瘤内注射后TME的免疫抑制
图S12
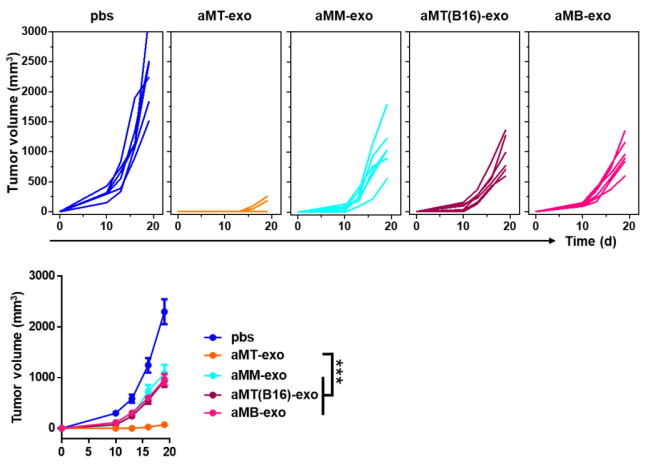
图S13
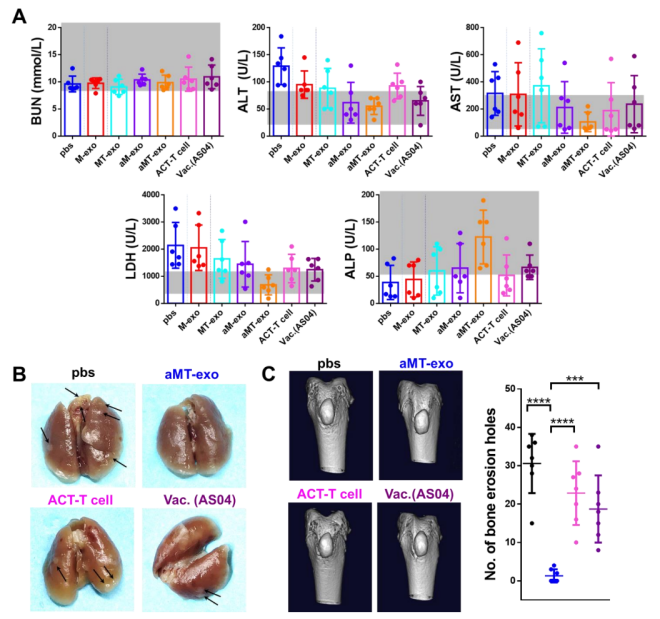
图S14
拓展阅读:
ACT(过继细胞疗法)
ACT是一种使用癌症患者自身具有抗肿瘤活性的T淋巴细胞,在体外扩增后再注入癌症患者体内的治疗方法。ACT具体过程为分离自体或异体免疫活性细胞在体外进行激活或基因修饰、扩增出足够数量的活性免疫细胞并进行功能鉴定后,再回输到患者体内,以达到直接杀伤肿瘤或激发机体内的免疫应答杀伤肿瘤细胞的作用。
ACT主要包括TIL、LAK、CIK、DC、NK、TCR-T、CAR-T等几大类。根据效应细胞来源以及其处理方式,可将ACT分为非特异性ACT和特异性ACT。非特异性ACT一般是指效应细胞来源于患者外周血中的免疫细胞,经淋巴细胞或细胞因子等协同刺激诱导,对杀伤肿瘤类型无特异性,对多种肿瘤细胞均具有杀伤作用。非特异性ACT包括:淋巴因子激活的杀伤细胞(LAK)、细胞因子诱导的杀伤细胞(CIK)、自然杀伤细胞(NK)。特异性ACT是指效应细胞具有识别肿瘤抗原的能力,能够特异杀伤相应类型的肿瘤细胞。特异性ACT包括:肿瘤浸润淋巴细胞(TIL)、T细胞受体基因修饰的T细胞(TCRT)、嵌合抗原受体修饰的T细胞(CAR-T) 。
但ACT技术也面临着许多难题,如T细胞扩增与持久性还有待加强、出现T细胞功能障碍、肿瘤异质性和抗原缺失等问题。
参考文献:
1. Sonia Guedan.et al. Annual Review of Immunology. 2018.
肿瘤疫苗
肿瘤疫苗(tumor vaccine)是近年研究的热点之一,其原理是将肿瘤抗原以多种形式(如肿瘤细胞、肿瘤相关蛋白或多肽、表达肿瘤抗原的基因等)导入患者体内,克服肿瘤引起的免疫抑制状态,增强免疫原性,激活患者自身的免疫系统,诱导机体细胞免疫和体液免疫应答,从而达到控制或清除肿瘤的技术。
目前,已上市和正在开发中的肿瘤疫苗大致可分为4类:全细胞疫苗、肿瘤多肽疫苗、基因工程疫苗和抗体肿瘤疫苗。
1、全细胞疫苗
肿瘤全细胞疫苗包含了全系列的肿瘤相关抗原(TAA),富含CD8 T细胞CD4辅助T细胞的抗原表位,能同时表达MHCⅠ和Ⅱ类限制性抗原,引起全面有效的抗肿瘤应答、诱导形成长效记忆T细胞。
肿瘤全细胞疫苗的传统制备方法是采用物理、化学或生物方法(紫外线照射、加热和神经氨酸酶等)处理选取自体或同种异体肿瘤细胞,该疫苗保留了免疫原性但无致瘤性。随着现代生物技术的发展,目前已能实现目的基因片段在肿瘤细胞的导入,如:MHC-1分子、共刺激细胞因子(IL-2、IL-12和GM-CSF)等,免疫原性进一步提高。
2、多肽疫苗
采用肿瘤细胞表面洗脱的抗原多肽或肿瘤细胞内部异常表达的蛋白制备多肽疫苗,具有特异性强、安全性高的优点。进一步对氨基酸残基修饰、氨基酸序列改变或者制备热休克蛋白-肽复合物,不仅可有效提高多肽抗原的特异性,而且避免与宿主细胞相似导致自身免疫。随着大量肿瘤抗原和多肽表位的发现,以及相应免疫方案的提出和实施,多种肿瘤多肽疫苗逐渐进入临床研究。
3、基因工程疫苗
利用基因工程技术将编码肿瘤特异性抗原的基因负载到重组病毒载体或质粒DNA上,直接注入人体。借助载体本身或者人体基因表达系统,能持续引起特异性的体液免疫和细胞免疫,这是基因工程疫苗较其他肿瘤疫苗无法比拟的优势,因而成为肿瘤生物治疗研究的热点。研究证明,将编码细胞因子、细菌蛋白的DNA与基因工程疫苗的质粒DNA融合,可以有效提高其免疫原性,引起强免疫应答 。
4、抗体肿瘤疫苗
根据依赖抗体细胞介导的细胞毒性作用(ADCC)理论设计的单克隆抗体肿瘤疫苗,是疫苗发展的一个新方向。单抗与相应的抗原能高度特异性结合,具有较好的分子靶向功能。目前,单克隆抗肿瘤药物有两类:一是抗肿瘤的单抗;二是抗肿瘤单抗耦联物,或称免疫偶联物。单克隆抗体药物与肿瘤抗原结合,共同刺激DC,激发CD8 T细胞作用,这项技术在黑色素瘤和乳腺癌治疗上获得显著进展。
7. aMT-exos靶向肿瘤转移部位,表现出较强的抗转移作用
先前研究提出,原发性肿瘤可能通过促进支持性转移环境的形成来诱导其他肿瘤细胞的转移,这种环境被称为转移前生态位(PMNs),它们是转移细胞定居的肥沃土壤。同时,也有研究表明,肿瘤细胞可以向PMNs分泌外泌体,这些外泌体可以为肿瘤的后续转移提供良好的微环境。因此,作者假设嵌合aMT-exos可以继承肿瘤外泌体的PMNs归巢能力。为了研究aMT-exos是否对转移位点具有靶向性,作者将表达荧光素酶的乳腺癌肿瘤细胞报告系(Luc-4T1)通过尾静脉注入BALB/c小鼠体内,建立肺转移瘤模型。10天后,作者皮下注射了DiD标记的4T1-aMT-exos到这些小鼠体内,再过3天后,采集肺组织和肿瘤转移肿块,监测荧光素酶信号和DiD荧光信号的共定位。发现在DiD- aMT-exos处理的小鼠肺转移肿块中,DiD信号与来自Luc-4T1细胞的荧光素酶信号共定位,显示4T1 -aMT-exos具有转移肿瘤归巢靶向能力(图6A)。为了探讨aMT-exos是否在转移性病灶内保持TME调节能力,作者采集肺部组织并使用多光谱组织成像技术进行染色分析(CD206起到指示作用)。结果显示,aMT-exos注射后肺转移瘤区域的红色M2巨噬细胞显著减少(P < 0.01)(图6B),表明aMT-exos处理后转移生态位的TME有了改善作用。作者同样使用这个模型来研究aMT-exos的抗转移潜能(图6 C),作者观察到肺转移信号降低,其他主要器官如心、肝、脾、肾无转移,小鼠体重保持稳定,这表明aMT-exos治疗抑制了肿瘤转移的范围(图6D和图S15, A和B)。
为了阐明程序性死亡受体1(PD-1)及其配体信号通路在肿瘤诱导的免疫逃逸中的作用,人们积极研究该通路的阻断性治疗方式,并探索结合其他治疗方法,进一步提高治疗效率。在本研究中,作者探讨了aMT-exos和PD-1抗体(a-PD1)在小鼠转移模型中的相互作用。肿瘤接种后进行aMT-exos与a-PD1联合治疗后,观察到的红色M2巨噬细胞进一步减少,并且在肺转移瘤区域观察到了CD206,以及明显的绿色CD8 T细胞浸润(图6B)。联合组CD8 T细胞与Treg细胞比值显著升高(P < 0.01)。结果表明,这种联合治疗抑制了4T1细胞的肺转移。同时,联合治疗组的转移灶与PBS对照组相比降低了23倍(P < 0.0001),比aMT-exos单药治疗组相比降低了7倍(P < 0.0001)(图6E)。同样地,为了检验这种抗转移作用是否也发生在其他肿瘤类型,作者通过尾静脉注射B16肿瘤细胞到C57BL/6小鼠体内,用B16- aMT -exos、a- PD1或两者联合治疗,建立了B16肺转移模型(图6)。同样,结果发现与单一治疗相比,联合治疗小鼠的M1/M2比值和CD8 T浸润显著增加(P < 0.01)(图6G)。同时,作者还观察到了aMT-exos单药治疗显著的抗转移作用(P < 0.0001),以及与a-PD1联合治疗的进一步抗转移作用(图6H,图S15, C和D)。
图S15
拓展阅读:
肿瘤转移是导致癌症患者死亡的主要原因。转移位点的始发态微环境称为转移前生态位,是显性转移的先决条件之一。 不同种类的癌症和肿瘤都会威胁患者的生命,很大程度是因为肿瘤细胞会离开它们生长的主要部位,发生转移。癌细胞是否会转移不仅取决于细胞本身,还取决于远处被称为转移生态位(metastatic niche)的微环境。
在转移生长的早期阶段,癌细胞产生一个局部肿瘤微环境(转移生态位),这与正常组织结构不同,是支持肿瘤细胞转移生长的关键。
研究发现肿瘤发生转移前会在靶器官建立转移前生态位,为转移的肿瘤细胞提供适合和支持其定植的微环境。转移前生态位的建立涉及信号的传递和响应。原发肿瘤释放信号分子,直接或间接地改变靶器官部位细胞的行为,进而细胞分泌黏附因子、炎性因子、基质金属蛋白酶等,最终形成利于转移细胞定植的生态位。
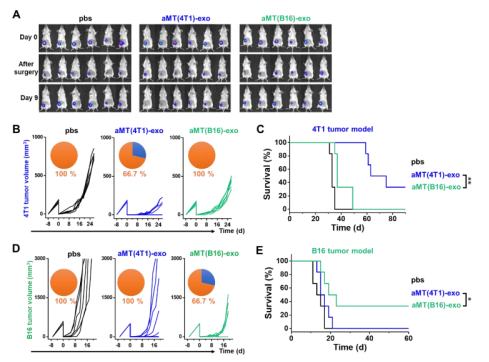
8. 个性化aMT-exos可有效防止术后肿瘤复发
为了更好的反应临床肿瘤病患治疗的实际状况,作者还对aMT-exos防止术后肿瘤复发的能力进行了研究。据此,作者建立了Luc-4T1肿瘤不完全切除模型。其中,“个性化”的aMT(4T1)- exos是从切除的肿瘤组织中分离单个细胞核来制备的(图7A)。作者最初测试了个性化的aMT-exos:即装载了DiD染料并从切除的组织中制备aMT-exos,检测其是否保留了靶向相同初始癌部位残留肿瘤细胞的能力。结果显示,皮下注射DiD- aMT-exos 48h后,在肿瘤残余区域和肿瘤周围均可观察到DiD信号的聚集(图7 B)。
接下来,作者检测从切除的组织中制备的嵌合外泌体是否对防止复发性肿瘤的发展起作用。与先前研究相类似,术后荷瘤小鼠使用个性化的aMT-exos、a- PD1或两者的联合治疗,并基于来自Luc-4T1癌细胞的生物发光信号和游标卡尺测量来进行分析和监测单个肿瘤的生长。结果显示:与PBS对照组相比,接受个体化aMT-exos单药治疗的小鼠可有效防止局部肿瘤复发(第14天肿瘤复发率为66.7%,而第14天为100%),且生存率更高(P < 0.05)(图7、D)。a-PD1联合治疗进一步降低了局部肿瘤复发率至16.7%,接受联合治疗的6只小鼠中有4只存活了至少100天。联合治疗后,也消除了术后4T1细胞的肺转移和骨转移
(图S16, A至C)。同样,使用B16肿瘤术后复发模型的类似实验也获得了类似的结果(图7E)。此外,个体化B16-aMT-exos和a-PD1的联合治疗将局部肿瘤复发率从100%降低到33.3%,接受联合治疗的小鼠中有55.6%存活了至少100天。除了个性化外泌体,作者还制备了来自杂化巨噬细胞与异质性肿瘤细胞核的“非个性化”外泌体,并将二者进行比较。与预期相一致,非个性化的外泌体治疗效果显著降低(P < 0.05)(图S17),再次证实了使用个性化外泌体的重要性。因此,这些结果表明,aMT-exos具有发展潜力,可以从切除的组织中制备个性化治疗药物,且当与a-PD1联合使用时能够提供强大的抑制肿瘤复发的效果。
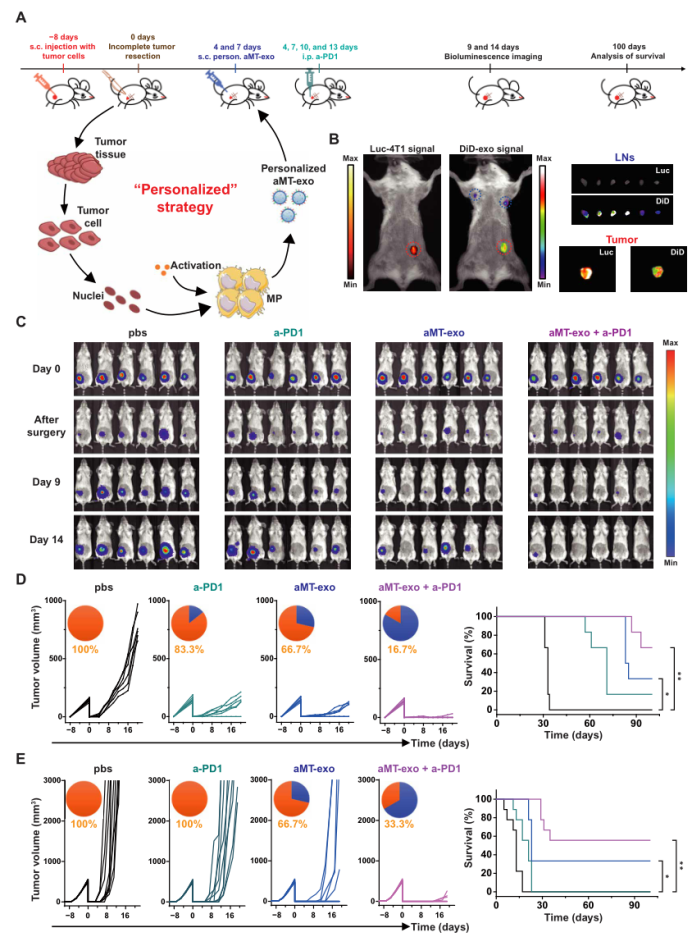
图7.aMT-exos靶向肿瘤转移部位,表现出较强的抗转移作用
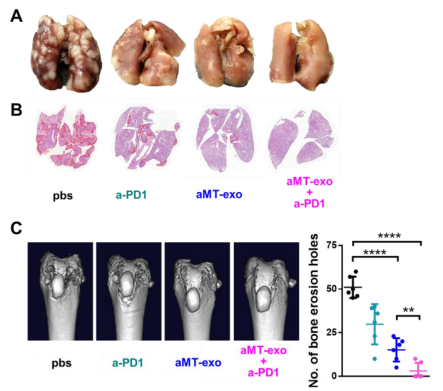
图S16
图S17
结语
在本篇研究中,作者评估了aMT-exos(巨噬细胞-肿瘤嵌合外泌体)可在LNs和实体肿瘤中积累,并随后诱导时空免疫调节抑制肿瘤。本文介绍了从小鼠E.G7淋巴瘤细胞、小鼠4T1三阴性乳腺癌细胞、小鼠B16黑素瘤细胞、以及从MDA-MB-231人三阴性乳腺癌细胞中分离得到的肿瘤细胞核,与M1巨噬细胞孵育,并制备出生物学重编程的巨噬细胞-肿瘤嵌合外泌体,称为激活的巨噬细胞-肿瘤细胞外泌体(aMT-exos),该外泌体能够通过增强免疫作用和改善TME来抑制肿瘤增殖和迁移。总之,本篇文章阐明了生物学上重新编程的嵌合APC -肿瘤细胞外泌体可以作为增加T细胞产量和调节免疫抑制的双重效应的概念。证实了能够利用从患者身上获取的肿瘤材料来制备个性化的免疫刺激纳米疗法来更好的在临床上抑制癌症复发的设想,为后续肿瘤的药物研究带来希望。
关注微信公众号代谢学人
了解更多前沿资讯

https://m.sciencenet.cn/blog-3483272-1327939.html
上一篇:代谢学人-Cell Metabolism 1月刊代谢精选
下一篇:代谢学人——Cell metabolism: 产热和炎症也有“性别歧视”?