博文
[转载]代谢学人--Science:LYCHOS--胆固醇的神秘感受器
|||
代谢学人
Science:LYCHOS--胆固醇的神秘感受器
撰文 | 申芸佳 朱丽君 刘爽 曹玉香 李国强
编辑 | 孟美瑶
校对 | 刘爽

背景介绍
胆固醇是生物膜的基本组成部分,也是一种信号分子,作为氧化甾醇和类固醇激素的前体或配体调节胚胎发育等多种生理过程。胆固醇含量和活性异常均与肥胖、动脉粥样硬化、不孕和癌症等病理状况息息相关,因此机体对胆固醇变化的精确感知是非常重要的。例如,内质网(ER)中存在一种控制胆固醇水平的蛋白质网络,该网络的关键成分是Scap,一种结合胆固醇的四聚ER膜蛋白。胆固醇结合可防止Scap将SREBP运输到高尔基体进行活化。当Scap结合的胆固醇超过总ER脂质的5%(摩尔基)时,SREBP-2转运突然受阻。当 ER 胆固醇降至 5% 阈值以下时,运输恢复。当细胞过度表达Insig-1(一种Scap结合蛋白)时,5%的阈值降低到3%。胆固醇、Scap和Insig之间的合作相互作用创造了一个灵敏的开关,以惊人的精度控制细胞膜的胆固醇组成。内质网的这一特定机制可感知局部胆固醇浓度,并相应地调整胆固醇的合成和吸收速率。
在癌细胞等增殖旺盛的细胞中,磷脂酰肌醇3-激酶(PI3K)-AKT-雷帕霉素复合体1(mTORC1)通路激活胆固醇的从头合成和胆固醇合成中间体的吸收,(小编注:PI3K,由一个调节亚基(p85)和一个催化亚基(p110)组成。当配体与膜受体结合后,受体激活p85并招募p110,进而催化膜内表面的PIP2生成PI3P。PI3P作为第二信使,进一步激活AKT和PDK1。Akt可直接磷酸化PRAS40,使其对mTORC1抑制作用失效,从而激活mTORC1通路。mTROC1通路激活后会激活SREBP,使得磷酸戊糖途径通量增加,导致NADPH和合成脂质的富碳前体增加。此外,mTORC1激活引起的HIF1α表达增加允许从氧化磷酸化转变为糖酵解,通过促进糖酵解中间体对戊糖磷酸和丝氨酸/甘氨酸合成途径的使用来支持合成代谢,为脂质的合成提供必要的前体)以满足其对胆固醇本身及其促进生长的生物合成中间体不断增加的需求。然而,胆固醇在细胞中的定位及其丰度是如何调节相应生理过程还不甚清楚。
溶酶体是细胞内关键的营养感知中心。在溶酶体上,主要的生长调节蛋白激酶mTORC1感应许多环境信号,包括营养物质、生长因子、能量、氧气和应激,并相应地触发下游合成代谢程序,促进细胞增长。当细胞内营养物质(包括胆固醇)浓度增加时,mTORC1定位于溶酶体膜上,与小G蛋白Rheb结合,激活mTORC1激酶功能进而促进细胞的合成代谢。相反,当营养物质含量较低时,mTORC1重新定位到细胞质中并保持不活跃状态,直到营养物质浓度恢复。
多种蛋白质控制着mTORC1在溶酶体上的营养依赖性定位。Rag GTPases是一个由RagA或RagB与RagC或RagD复合而成的异二聚体。当营养物质充足时,GTPases与RagA或RagB相结合,RagA/C形成“猛禽爪”进而与mTORC1物理结合,并将mTORC1锚定在溶酶体膜上。mTROC1在溶酶体膜上被小G蛋白Rheb GTPase复合物结合后被激活,通过磷酸化p70S6激酶1(S6K1)和eIF4E结合蛋白1(4E-BP1)这两个关键效应物来促进蛋白质合成。活化的S6K1磷酸化许多底物,包括S6,eIF4B和PDCD4以促进整体mRNA翻译。mTORC1会促进SREBP1和SREBP2表达,引起脂肪酸和甾醇合成增加。mTROC1激活促进嘌呤和嘧啶从头合成途径以及丝氨酸/甘氨酸生物合成,支持生长细胞中DNA和RNA复制。mTROC1激活增加HIF1α表达,引起氧化磷酸化转变为糖酵解,为蛋白质、核苷酸和脂质的合成提供发了必要的前体。反过来,RagA或RagB的核苷酸状态由其他与溶酶体相关的蛋白质控制。GATOR1复合体是RagA专门的GTPase激活蛋白(GAP)。当营养浓度较低时,GATOR1触发RagA上的GTP水解,从而抑制Rag GTPase复合物的活性,导致mTORC1在细胞质中的重新定位和失活(小编注:小G蛋白Rheb只能在溶酶体膜表明维持其活性GTP结合状态。当营养物质缺乏时,GTP 结合活性降低,mTORC1与Rheb解离,不再被激活。)。GATOR1的这种负调控活性被亮氨酸、精氨酸和蛋氨酸所抵消,通过特定的传感器直接或通过GATOR2复合物间接抑制GATOR1的GAP活性。胆固醇是否调节GATOR1对RagA的GAP活性尚不清楚,但与这种可能性一致的是,即使胆固醇浓度很低,GATOR1的基因失活也会使mTORC1具有组成性活性。

不同营养状态下mTORC1的抑制和激活
图片来源:H. R. Shin, R. Zoncu, Dev. Cell 2020.54, 226–238
在体内外实验中,溶酶体膜上的胆固醇直接参与mTORC1的募集和激活。这个胆固醇池受到高度调控:甾醇载体羟甾醇结合蛋白(OSBP)定位于ER—溶酶体膜接触位点,将胆固醇从ER转移到溶酶体(小编注:胆固醇合成主要在ER发生),激活mTORC1。相反,胆固醇转运体Niemann-Pick C1(NPC1)促进胆固醇从溶酶体表面输出到细胞其他部位发挥功能(小编注:由 Niemann-Pick C1 (NPC1) 和 NPC2 蛋白组成的甾醇转运系统特异性定位于溶酶体,它结合游离胆固醇并介导其输出到不同的细胞区室,包括质膜和ER),从而抑制mTORC1信号。
胆固醇如何与mTORC1相互作用具体机制还不清楚。各种胆固醇池共存于溶酶体膜上,一部分来源于低密度脂蛋白(LDL)(LDL与LDLR结合后转运到细胞中在溶酶体膜上被降解为胆固醇),另一部分沉积在ER和溶酶体膜接触位点上(胆固醇在此处由ER转运至溶酶体)。此外,溶酶体不同区域中的胆固醇浓度不同,这种情况伴随代谢状态的改变而改变。因此,就像对氨基酸的感应一样,对胆固醇的感应可能依赖于多种具有不同定位、对甾醇配体亲和力和上游调控机制的胆固醇感应因子。其中一个重要的因子是溶酶体跨膜蛋白SLC38A9,它通过跨膜结构域内保守的甾醇相互作用序列参与胆固醇依赖性激活mTORC1。然而,SLC38A9主要将精氨酸含量变化这一信号传递给mTORC1,而胆固醇的特定的传感器还有待确定。
溶酶体可能还有尚未发现的营养传感器,可以通过mTORC1依赖或非依赖立的途径调节细胞代谢。确定假定的营养传感器是具有挑战性的,因为它们通常与同源代谢物的相互作用较弱,并且具有不同的结构域组成和拓扑结构。近期发表在Science杂志上的一篇题为“Lysosomal GPCR-like protein LYCHOS signals cholesterol sufficiency to mTORC1”的文章中,基于对溶酶体蛋白质组学分析,结合生物信息学技术预测假定信号蛋白,研究人员对GPR155进行了鉴定,发现其可以作为一个候选的溶酶体胆固醇传感器,控制该细胞器的信号转导,并将其命名为溶酶体胆固醇感应蛋白(LYCHOS)。
拓展阅读
胆固醇感应途径
当细胞膜内胆固醇偏低的时候,会激活一种叫做固醇调节元件结合蛋白(SREBP)的表达,将信号传递给细胞核,细胞核做出反应,上调胆固醇合成所需要的一系列酶,从而增加合成胆固醇。同时LDL接收器表达增加,增加从血液中吸收胆固醇的含量,胆固醇从血液储备池中流出。于此同时,胆盐的合成被下调,合成胆盐所需的胆固醇也会下降。总的效果是体内的胆固醇总量上升。
当细胞膜内胆固醇过多时,会激发肝脏X受体,肝脏X受体会下调胆固醇合成速度,并且通过ABC转运蛋白把多余的胆固醇排出细胞,交给附近的高密度脂蛋白颗粒,于此同时,胆盐的合成和排出都被上调,体内的胆固醇总量下降。
胆汁是主要的胆固醇排出机制,另外一个是肠道胆固醇排出机制,大约35%的胆固醇通过这个途径排出,但当中的生化机制目前尚不清楚。

敲黑板啦!
1、LYCHOS是胆固醇激活mTORC1的一种必需蛋白;
2、LYCHOS通过与GATOR1相互作用促进mTORC1信号传导;
3、LYCHOS抑制GATOR1-KICSTOR的相互作用。
研究结果
1.LYCHOS是胆固醇介导的mTORC1激活所必需的
为了识别溶酶体中的营养感知因子,研究人员设计了一种生物信息学方法来分析“主列表”中的611种蛋白质,该列表包含了已发表的和未发表的溶酶体蛋白质组数据集(图1A、辅图1A和补充表1)。研究人员对该列表进行了GO分析,结果富集了与溶酶体相关的生物过程(辅图1B)。
研究人员选择了满足以下所有标准的蛋白质:(i)具有跨膜拓扑结构,这类蛋白通常在代谢物受体和“转运受体”中被发现;(ii)存在相对较大的环状结构,可促进细胞器之间的相互作用;(iii)存在与信号转导相关的结构域和结构;(iv)没有定位到其他膜室中的报道,无蛋白的多重功能作用(图1A)。溶酶体可以释放大分子分解产物到细胞质中,与此一致的是,UniProt(小编注:UniProt全称为Unified Protein Database,是信息最丰富、资源最广的蛋白质序列数据库,整合Swiss-Prot、TrEMBL和PIR三大数据库的数据而成。)中注释的5208个跨膜蛋白中,有127个溶酶体特异性跨膜蛋白在代谢产物转运和易位方面高度富集(图1B和辅图1C、1D)。
研究人员分析发现,有五个跨膜蛋白满足上述标准,分别是氯离子电压门控通道(CLCN)5、6、7,磷脂酶D家族成员3(PLD3)和G蛋白偶联受体155(GPR155)(图1C)。其中,GPR155(也称为DEP结构域)因其拓扑特征而脱颖而出。它包含有10次跨膜(TM)结构域的N端部分,与溶质载体(SLCs)相似;一个与B类GPCRs相似的7次TM结构域中心部分,该TM螺旋的15和16之间包含一个大的插入点(118个氨基酸);以及含有Dishevelled、Egl-10和Pleckstrin (DEP)结构域的C端部分。在UniProt和Alphafold对GPR155的结构预测结果的基础上,研究人员重新预测了GPR155的17-TM拓扑结构(图1D和辅图1E)。
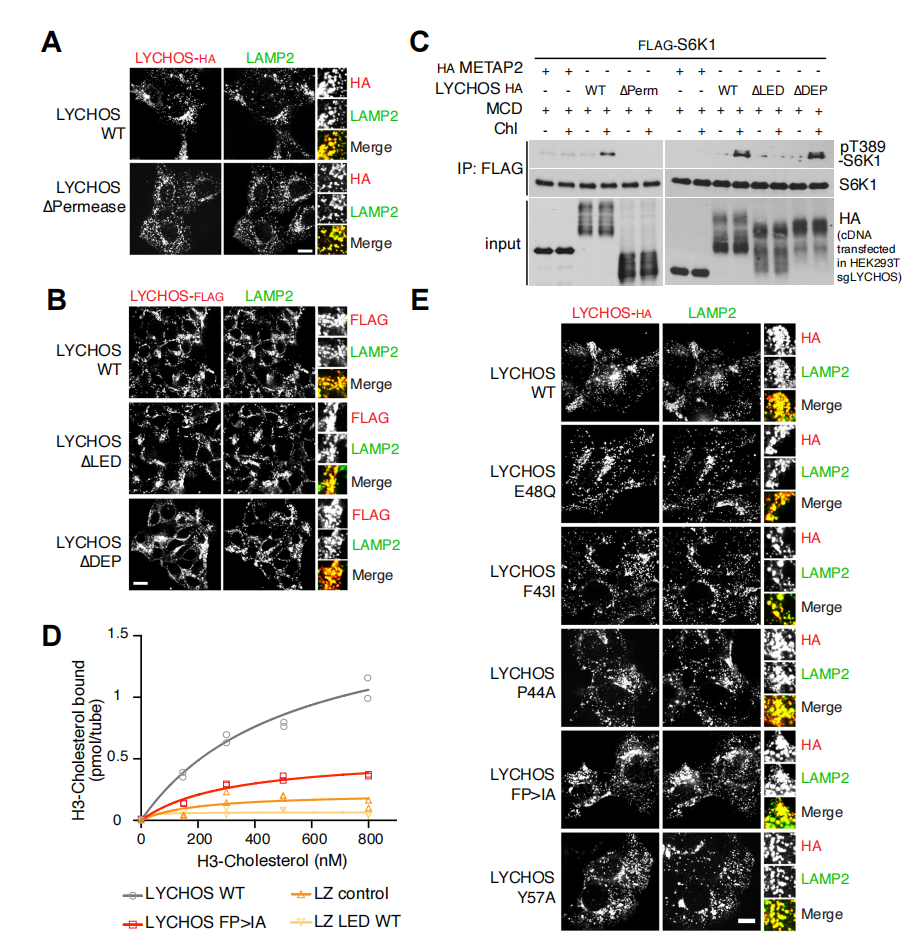
研究人员用内源蛋白抗体对溶酶体样本进行免疫沉淀,证实GPR155在溶酶体中的定位(辅图2A)。此外,研究人员还对在人胚胎肾(HEK)-293T细胞中稳定表达的内源性溶酶体相关膜蛋白2(LAMP2)和FLAG标记的GPR155进行双重免疫荧光分析。结果显示,GPR155特异性定位于溶酶体(LAMP2与GPR55共定位),在缺乏LAMP2(溶酶体定位的阳性对照)的囊泡结构,并且在高尔基体中或者在细胞质膜上没有检测到GPR155的信号(图1E和辅图2B、2C)。在半通透(小编注:用洋地黄皂苷使质膜被通透,溶酶体膜保持完整。)条件下,研究人员用特异性针对TM15-16环和DEP结构域的抗体进行免疫染色,发现这两个结构域都面向细胞质而不是溶酶体腔(辅图2D和2E)。由于GPR155的结构域具有信号传导特征,研究人员因此将GPR155称为溶酶体胆固醇信号蛋白(LYCHOS),其TM15-16环称为LYCHOS效应结构域(LED)。
接下来,研究人员探究了LYCHOS是否调节mTORC1的激活。结果显示,在营养充分的条件下,通过CRISPR-Cas9或shRNA抑制HEK-293T细胞中的LYCHOS表达,可以显著降低mTORC1的经典底物p70 S6-激酶1 (S6K1)和4E-结合蛋白1(4E-BP1)的磷酸化,说明抑制LYCHOS表达可以减弱mTORC1信号(辅图3A和3B)。相反,过表达LYCHOS可以以剂量依赖性的方式促进mTORC1底物的磷酸化(辅图3C)。以上结果表明,LYCHOS可以激活mTORC1。
与mTORC1信号减弱一致的是,LYCHOS的敲减可以显著抑制细胞增殖,而在LYCHOS缺失的细胞中重新表达LYCHOS,可以显著改善细胞增殖被抑制的现象(辅图3D和3E)。此外,研究人员还发现,在LYCHOS敲减细胞中,参与糖酵解、磷酸戊糖途径和脂质生物合成相关的基因表达量减少,这些基因表达特征与药理学方式抑制mTORC1时观察到的类似(辅图3F-3H)。而在LYCHOS敲减细胞中重新表达LYCHOS时得到逆转(辅图3H)。
研究人员对NIH基因表达综合图谱(GEO)数据库中611个溶酶体基因进行生物信息学分析,发现LYCHOS是小鼠空腹后肝脏、肌肉和脂肪组织中表达减少的8个溶酶体基因之一(辅图4A、B和补充表2)。为了证实这一发现,研究人员对小鼠分别进行禁食6小时和24小时处理后,取肝脏样本进行qPCR检测。结果显示,Lychos的表达随着禁食时间的增加而减少。相反,作为胆固醇依赖性的mTORC1负激活调控因子,Npc1(小鼠空腹后肝脏、肌肉和脂肪组织中表达增加的14个溶酶体基因之一)在禁食动物中表达量增加(辅图4D)。
研究人员紧接着探究了LYCHOS是否能通过特定的营养刺激激活mTORC1。结果显示,在LYCHOS敲除(KO)细胞中,通过急性饥饿—补充氨基酸(辅图5A)或葡萄糖(辅图5B)刺激后,mTORC1激活未受影响。相比之下,使用甲基β-环糊精(MCD)的复合物清除细胞中胆固醇后,再使用胆固醇刺激细胞,发现胆固醇激活mTORC1需要LYCHOS(图1F和辅图5C、5D)。
像氨基酸和葡萄糖一样,胆固醇可以诱导mTORC1从细胞质基质重新定位到溶酶体膜上。在LYCHOS KO细胞中,在MCD:胆固醇或LDL的刺激下,mTORC1未能定位到溶酶体上(图1G、H和辅图5E、F)。相比之下,LYCHOS缺失并不影响Rag GTPases或其膜锚定物(Ragulator/LAMTOR复合物)的溶酶体定位(辅图5G-5J)。因此,LYCHOS似乎是胆固醇依赖性激活mTORC1溶酶体支架复合物所必需的,而不是为了维持将其锚定在溶酶体上的Rag GFPase 或Ragulator/LAMTOR复合物的物理完整性。
拓展阅读
shRNA-resistant
shRNA是将短RNAi(一般为siRNA,19-21个核苷酸的RNA双链)克隆到表达载体并表达的 DNA 分子。在shRNA进入细胞并表达siRNA后,RNA 双链结合一个核酶复合物从而形成 RNA 诱导沉默复合物(RNA-induced silencing complex, RISC)。激活的 RISC 通过碱基配对定位到同源 mRNA 转录本上,达到目的基因沉默的效果。而shRNA-resistant则是通过设计点突变方式,将原先shRNA设计的靶向位置序列进行突变,导致其表达的siRNA无法识别到互补序列,进而达到抵抗shRNA沉默的作用。
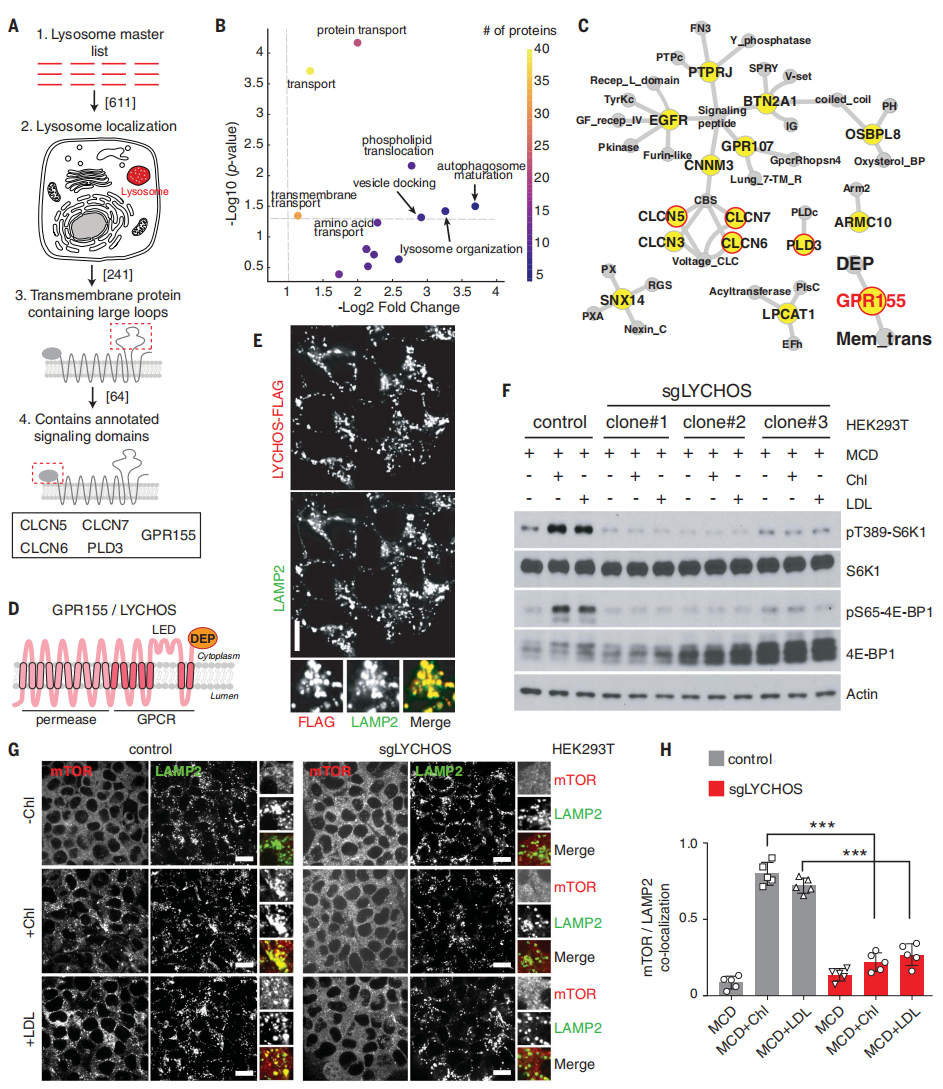
图1 溶酶体跨膜蛋白LYCHOS是胆固醇介导的mTORC1活化所必需的
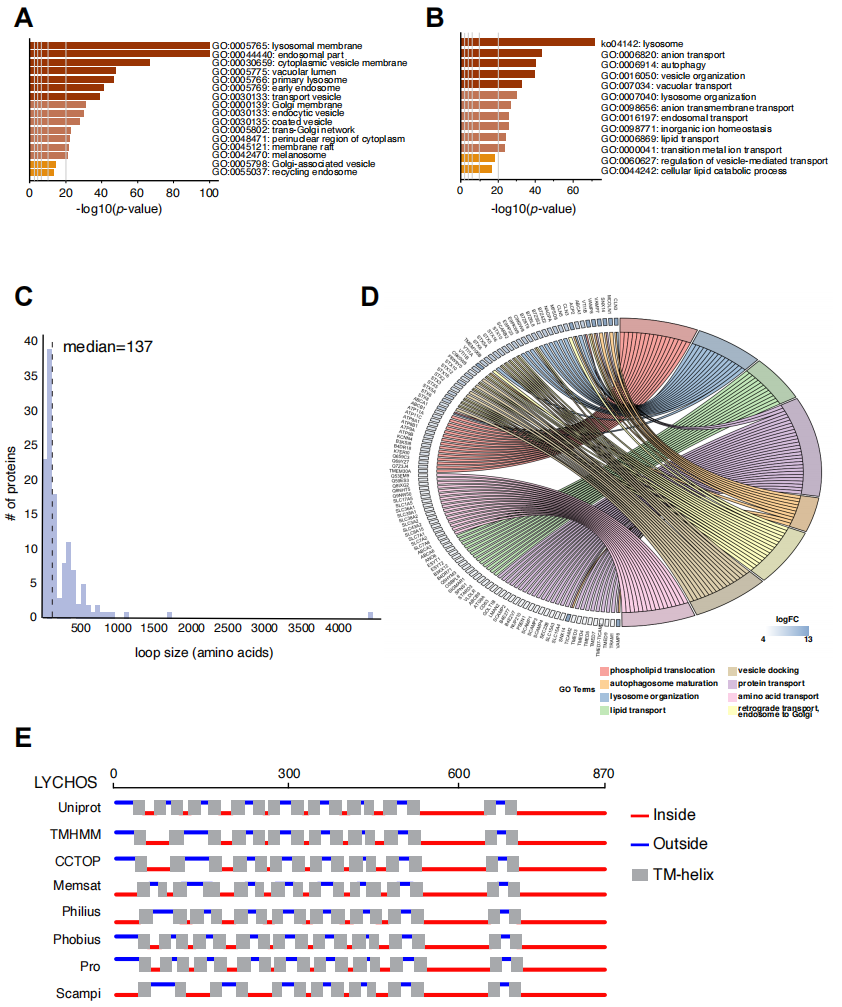
辅图1 溶酶体蛋白质组的生物信息学分析
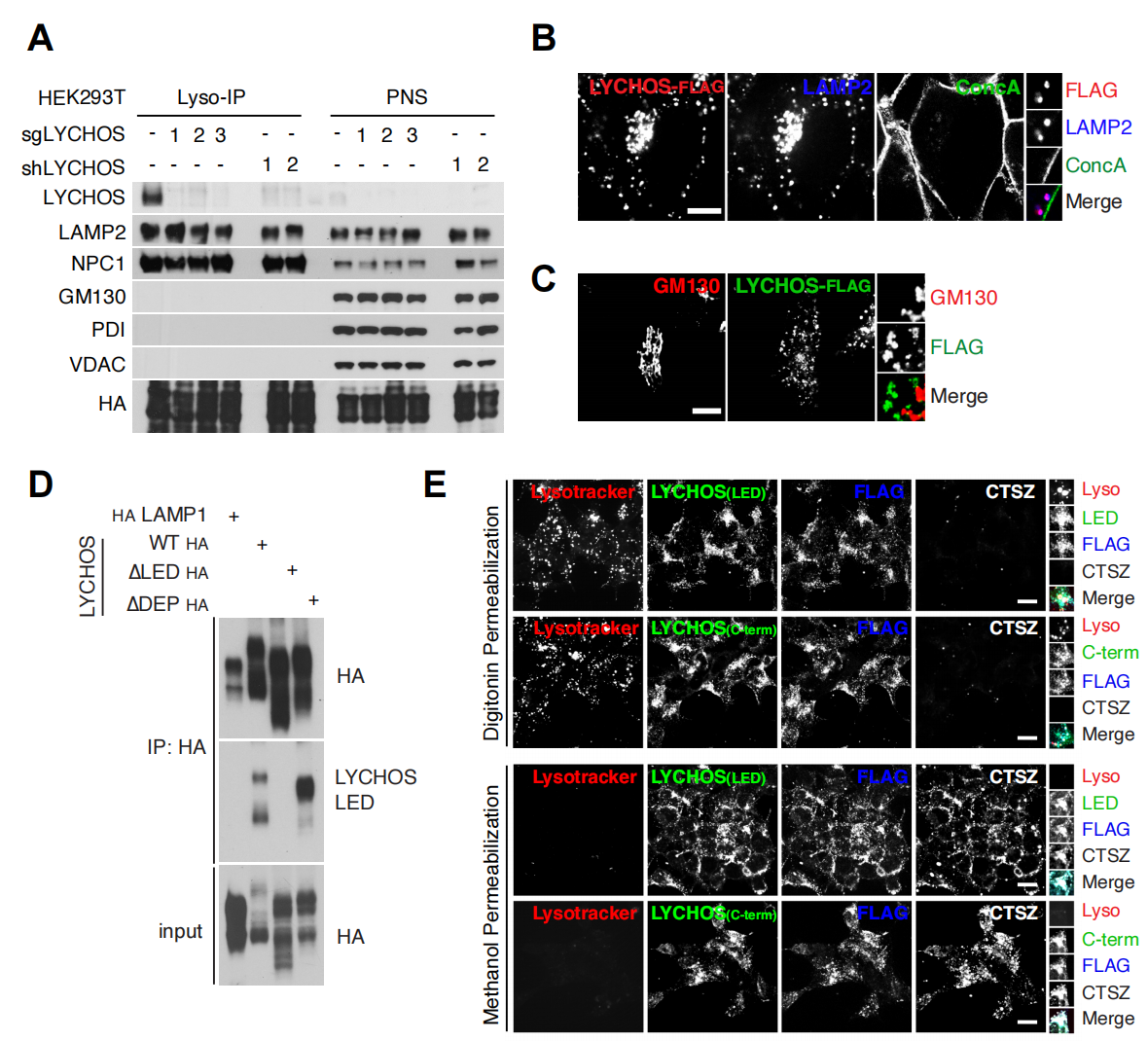
辅图2 LYCHOS是一种溶酶体跨膜驻留蛋白
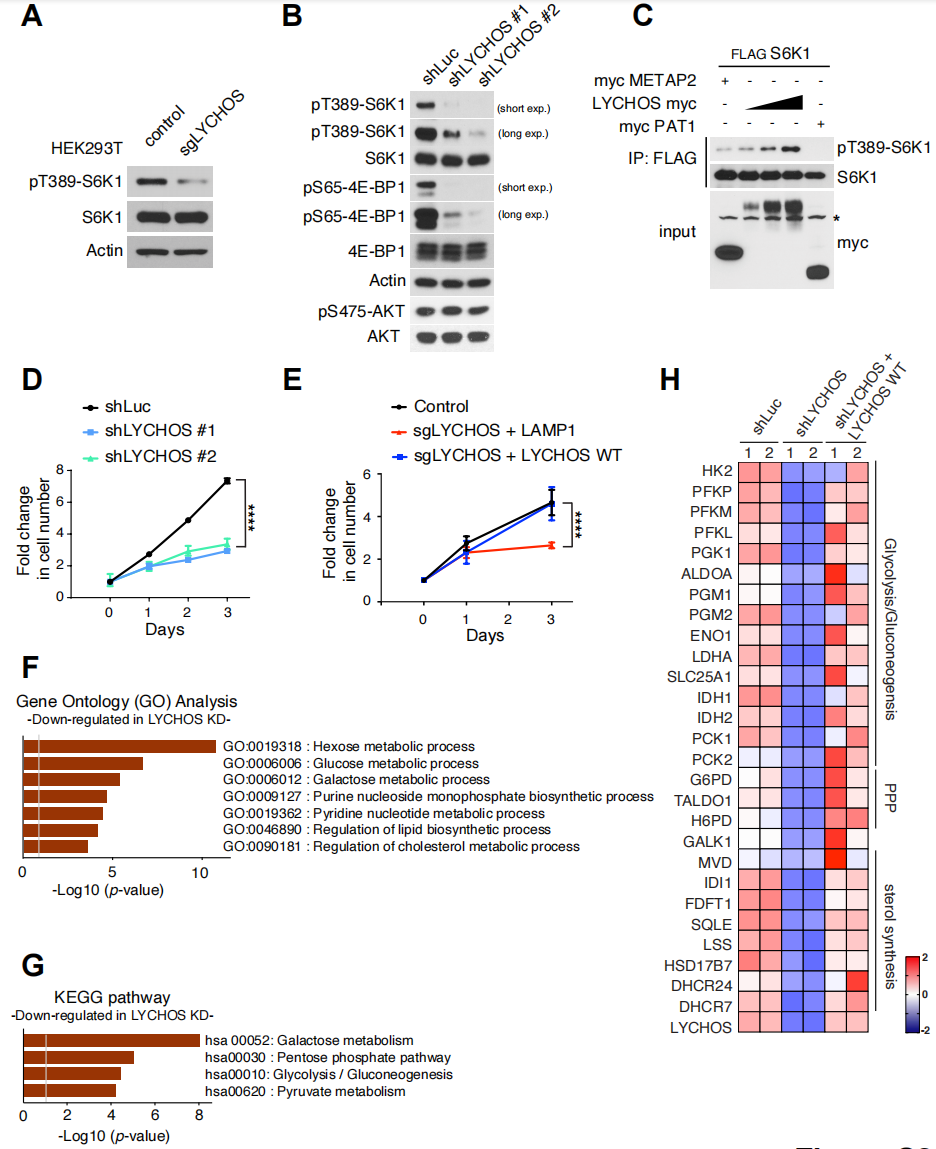
辅图3 LYCHOS是mTORC1激活所必需的
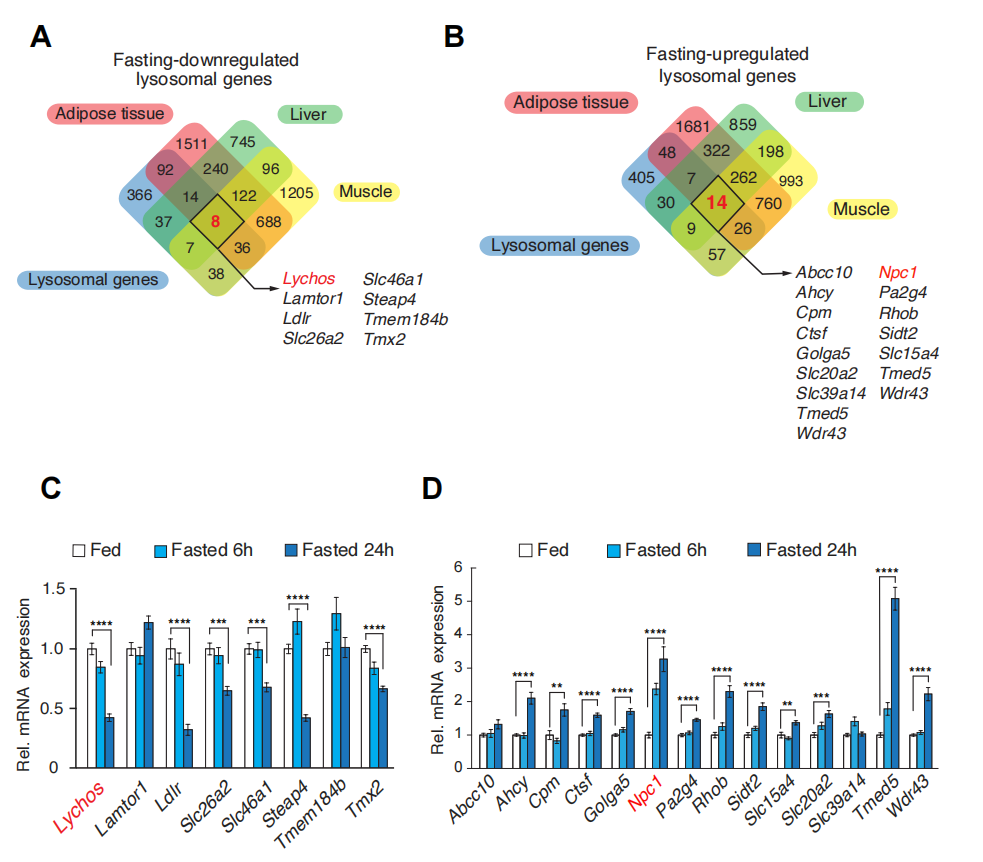
辅图4 Lychos的表达在小鼠肝脏、肌肉和白色脂肪组织中响应禁食而下调
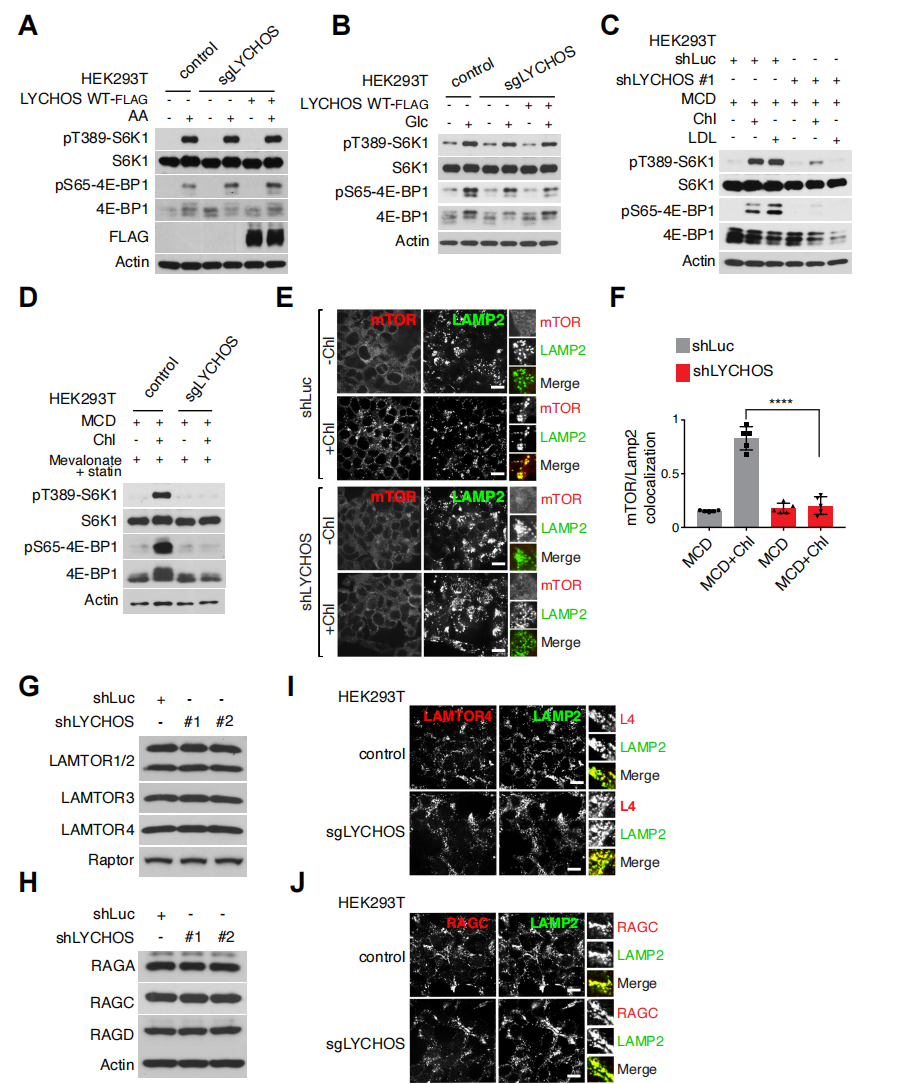
辅图5 LYCHOS是胆固醇依赖性mTORC1向溶酶体募集所必需的
2.LYCHOS通过其N端结构域与胆固醇结合
N-端渗透酶样(小编注:指存在于膜上能识别结合特异性底物后通过构象变化实现物质转移作用的跨膜蛋白)样结构域和两个信号模块(GPCR样和DEP)的存在表明,LYCHOS可能是一种胆固醇转运体或效应体。从对照细胞和缺乏LYCHOS的细胞中提取溶酶体并进行脂质组学分析,结果显示,在缺乏LYCHOS的细胞中,溶酶体总胆固醇含量没有显著差异(辅图6A和6B)。
研究人员在缺乏NPC1的细胞中抑制LYCHOS表达,结果发现,NPC1的缺失会导致胆固醇在溶酶体腔内和溶酶体膜上积累。紧接着分别用filipin和mCherry-D4h(一种基于产气荚膜梭菌毒素theta-toxin第四结构域的重组荧光标记胆固醇探针)对细胞中的胆固醇进行检测。结果显示,在缺少NPC1的细胞中,抑制LYCHOS表达并不能改变filipin或mCherry-D4H信号,而使OSBP(将胆固醇从ER转移到溶酶体膜)失活后,mCherry-D4H信号消失,filipin信号依旧存在(小编注:filipin与游离胆固醇结合形成复合物,产生荧光;而mCherry-D4h是插入到胆固醇的C端和胆固醇结合,OSBP失活后,LYCHOS的N端和胆固醇的C端结合,使得mCherry-D4H无法与胆固醇结合,也无法显示红色荧光。说明是LYCHOS与胆固醇进行了结合。)(辅图6C-E)。
NPC1的缺乏,以及由此导致的胆固醇在溶酶体膜上的积累,可以使mTORC1重构和异常活跃,活性增加。而在缺乏NPC1的细胞中抑制LYCHOS表达,则可以完全抑制mTORC1信号通路(辅图6F)。因此,LYCHOS虽然不能控制溶酶体胆固醇的浓度,但它是溶酶体胆固醇激活mTORC1所必需的。
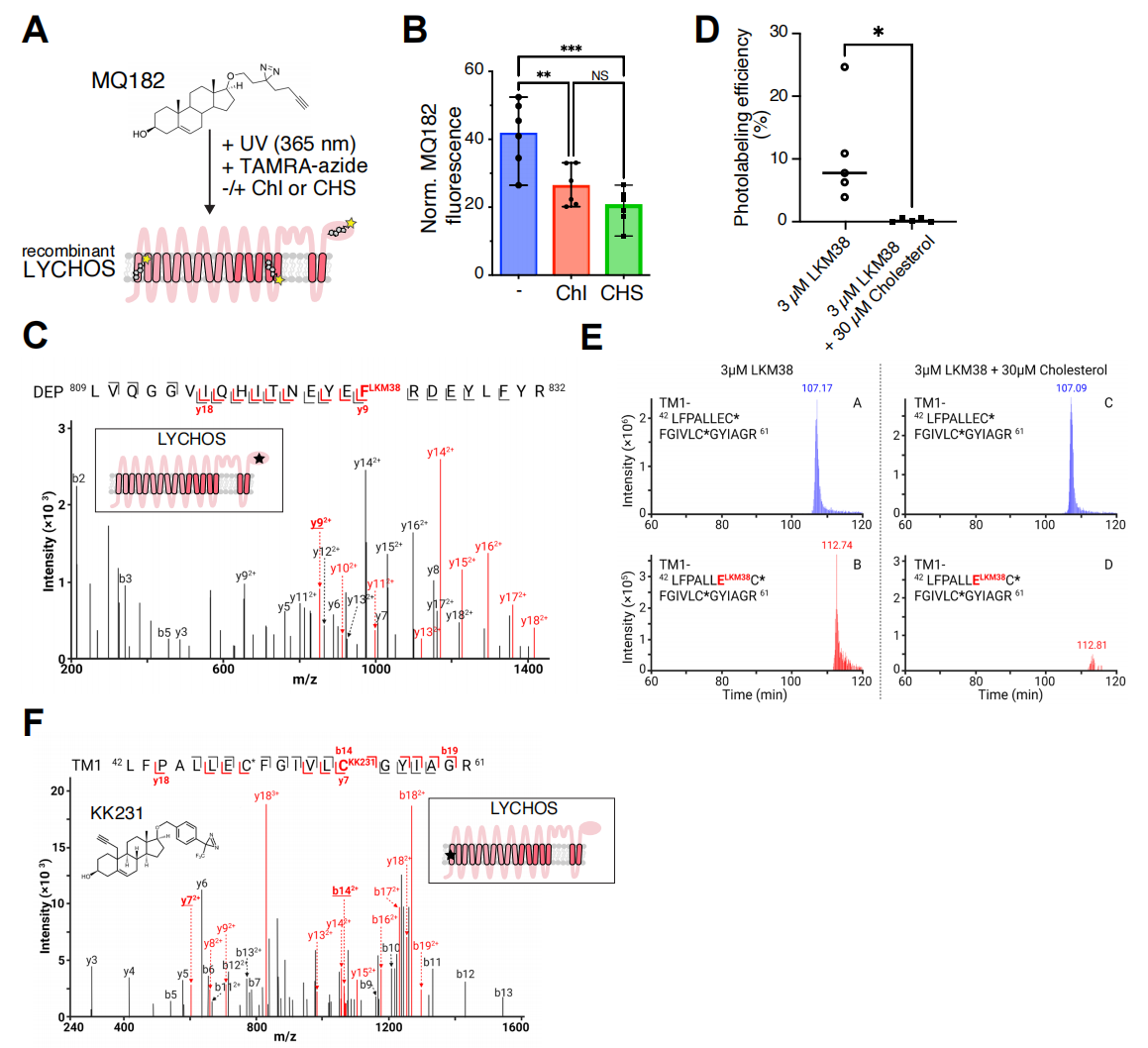
为了确定LYCHOS是否直接与胆固醇结合,研究人员表达了LYCHOS重组蛋白,并验证了其纯度(辅图7A和B)。在保持蛋白质稳定性的条件下,LYCHOS重组蛋白与浓度递增的[3H]-胆固醇共同孵育(辅图7C)。结果显示,LYCHOS表现出与[3H]胆固醇的结合是饱和的,解离常数(Kd)在100和200nM之间,该结合可被未标记的胆固醇竞争,但不能被胆固醇的3-OH同分异构体竞争(图2A、2B和补充表3)。胆固醇似乎是以立体异构的方式与LYCHOS结合,因为[3H]-胆固醇的结合被25-OH和19-OH胆固醇竞争,而不是与4β-OH胆固醇竞争,表明LYCHOS与胆固醇的结合对胆固醇特定位置结构的修饰很敏感(图2C和补充表3)。
确定了LYCHOS可直接与胆固醇结合后,为了找到LYCHOS与胆固醇的结合位点,研究人员利用光交联的胆固醇类似物标记重组表达的LYCHOS,该胆固醇类似物可通过结合紫外线激活的二氮嘧啶基团,生成的多肽类固醇加成物,并通过铜催化环加成和质谱法识别标记位点。结果显示,LYCHOS的大量光标记与过量的胆固醇或胆固醇半琥珀酸盐竞争,表明它们之间有特定的结合反应(辅图8A和8B)。用类似物LKM38对肽类固醇加成物进行质谱分析,发现了两个标记位点,第一个对应于跨膜螺旋1(TM1),位于渗透酶样样N端区域(42LFPALLECFGIVLCGYIAGR61),第二个对应于DEP结构域(809 LVQGGVIQHITNEYEFRDEYLFYR832)(图2D,辅图8C,补充表4和表5)。两个标记位点都可以被多余的游离胆固醇所竞争(图2E和辅图8D和8E)。此外,TM1位点被另一个胆固醇类似物KK231独立标记,该胆固醇类似物在脂质尾部带有光反应性的二氮嘧啶基团(辅图8F和补充表6)。
为了确定TM1或DEP是否代表mTORC1激活的胆固醇结合调控位点,研究人员构建了LYCHOS缺失的细胞,其异构体缺乏TM1包含的渗透酶样样结构域、DEP结构域或LED。所有三种修饰蛋白的表达量均与全长蛋白的表达量相当,且定位于溶酶体(辅图9A-C)。缺乏DEP对胆固醇依赖性的mTORC1激活没有影响,缺乏渗透酶样样结构域或缺乏LED可以抑制胆固醇依赖性的mTORC1激活;然而,重组表达的的LED(由亮氨酸拉链保持环形结构),不能与[3H]胆固醇相结合(辅图9C-D)。这说明DEP或LED并非mTORC1激活的胆固醇直接结合调控位点。因此,研究人员又进一步研究了TM1作为胆固醇依赖性的调控位点。
已知芳香族氨基酸通常存在于胆固醇结合区域中。TM1结构域有两个保守的芳香族残基Phe43和Tyr57,位于LKM38和KK231(分别为Glu48和Cys55)形成复合物的位点附近(图2D和辅图8F)。研究人员在LYCHOS缺失细胞中过表达Phe43→Ile突变体,发现胆固醇依赖性的mTORC1激活减弱(图2F)。邻近的Pro44可能有助于建立胆固醇结合袋的构象。与这种可能性相一致的是,[3H]-胆固醇与F43I-P44A双突变体LYCHOS的结合几乎被消除,而且这种双突变体比F31I或P44A单突变体具有更强的mTORC1激活缺陷(图2F和G)。相比之下,将Glu48突变为Gln对mTORC1信号传导没有影响,这表明这种由LKM38的光活性二氮嘧啶标记的残基不参与LYCHOS和天然胆固醇的结合(图2F)。最后,将第二个芳香残基Tyr57突变为Ala,胆固醇依赖性的mTORC1激活也随之减弱(图2H)。所有这些突变体都正确定位在溶酶体上,并以几乎相同的量表达(图2F和H,辅图9E)。综上,TM1结构域中两个芳香残基Phe43和Tyr57是胆固醇依赖性mTORC1激活的调控位点。
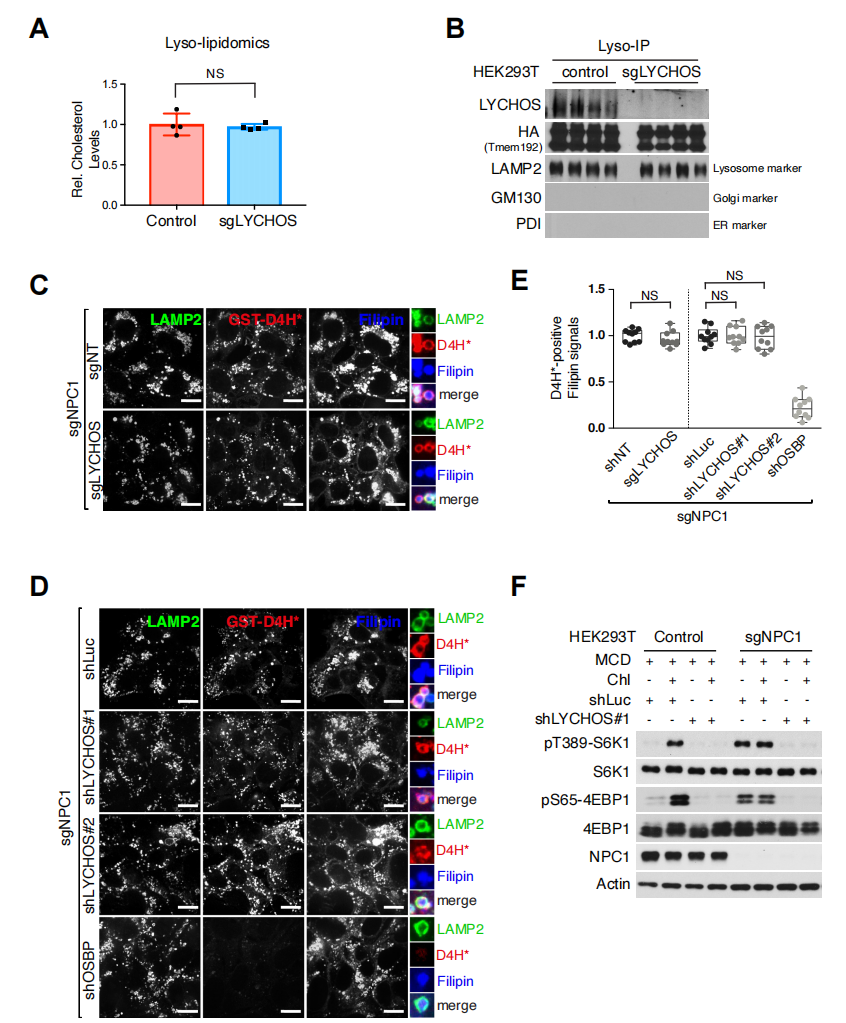
辅图6:LYCHOS不调节溶酶体胆固醇水平
辅图7 重组表达的LYCHOS蛋白表现良好、稳定
辅图8 紫外线活化胆固醇类似物对LYCHOS的光标记
辅图9 胆固醇依赖性mTORC1激活LYCHOS结构域的缺失分析
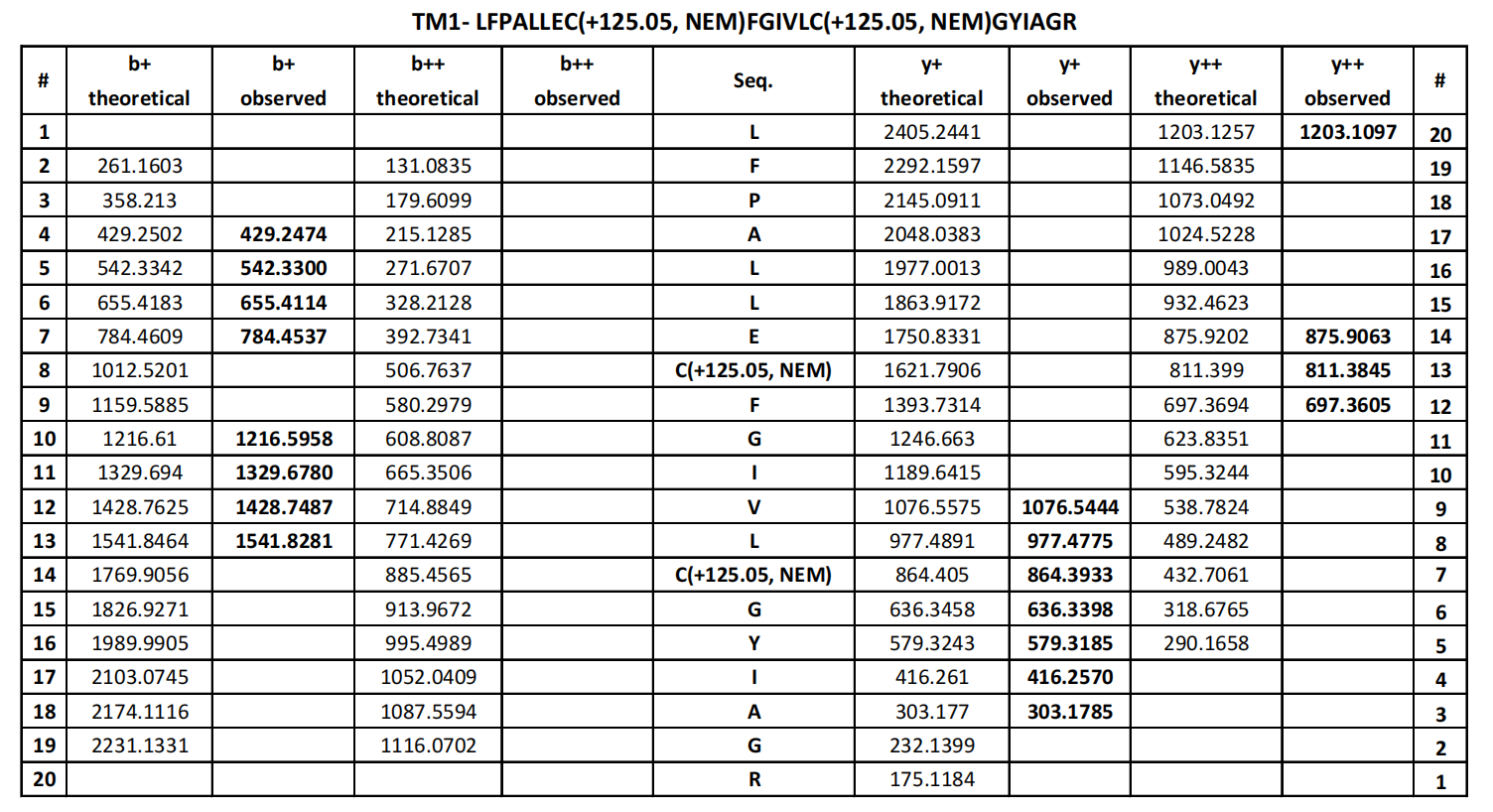
补充表4 产品离子表LKM32标记TM1肽
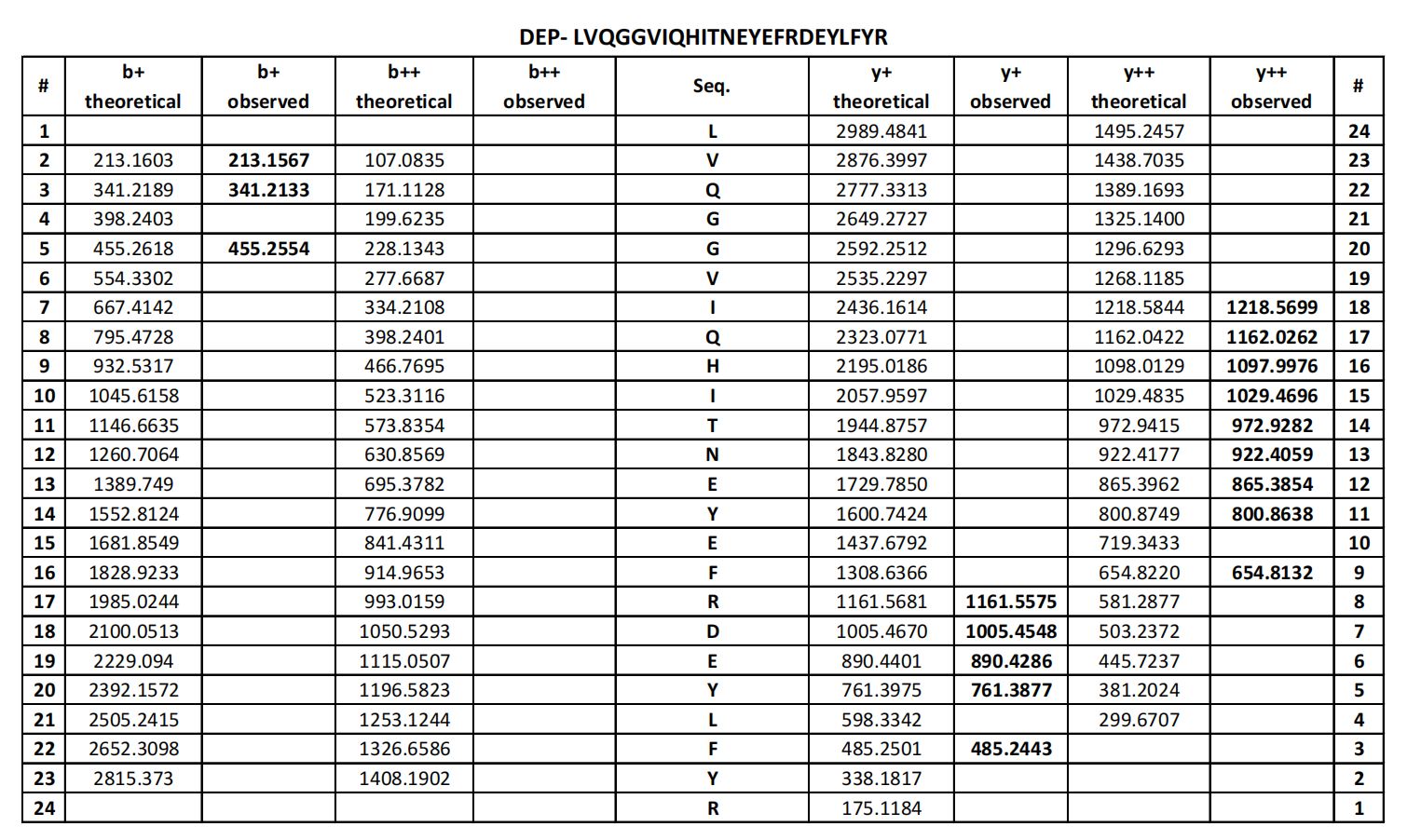
补充表5 产品离子表LKM32标记的DEP肽
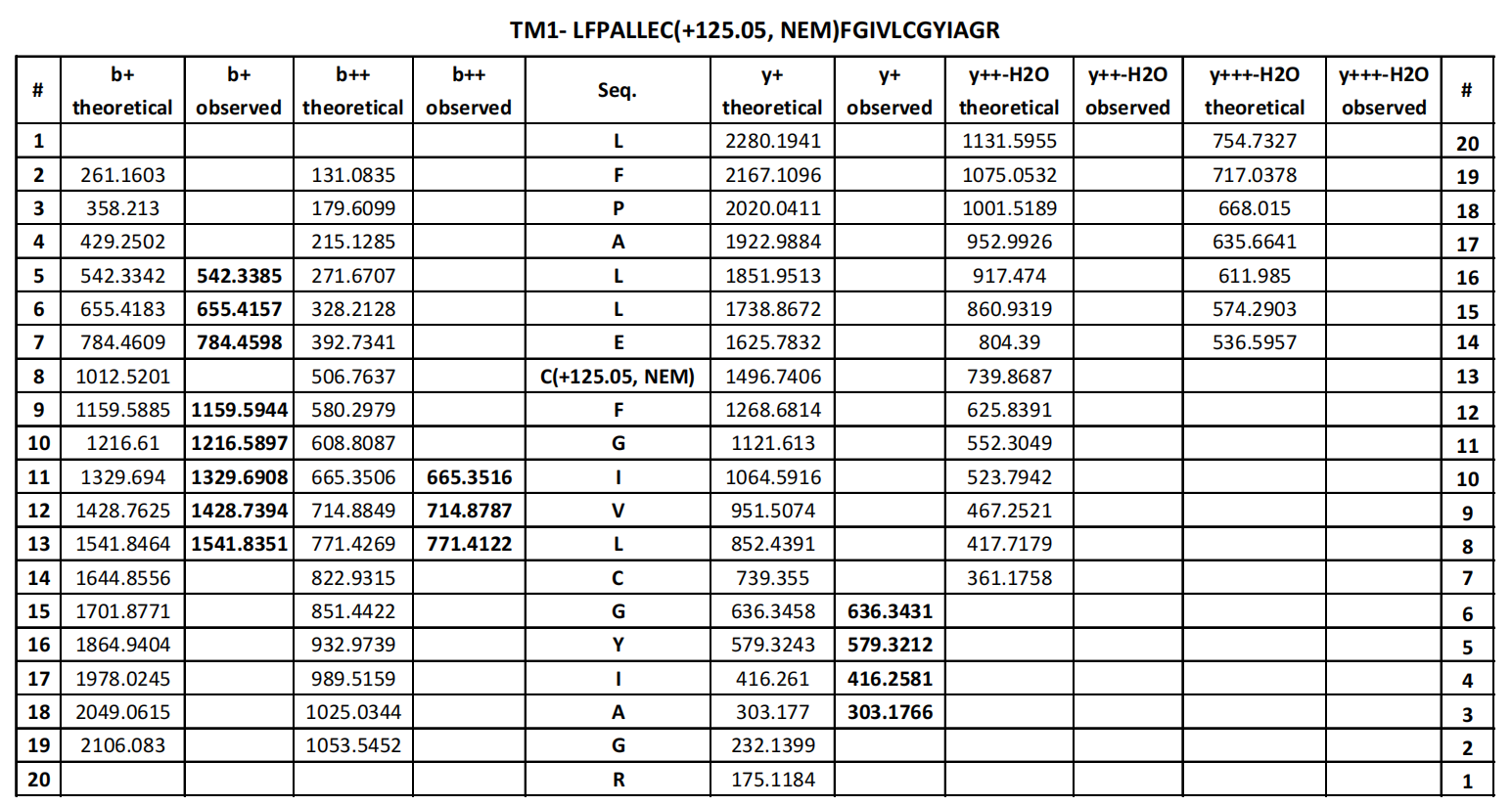
补充表6 产品离子表KK231标记TM1肽
3.LYCHOS通过胆固醇调控与GATOR1的相互作用促进mTORC1信号转导
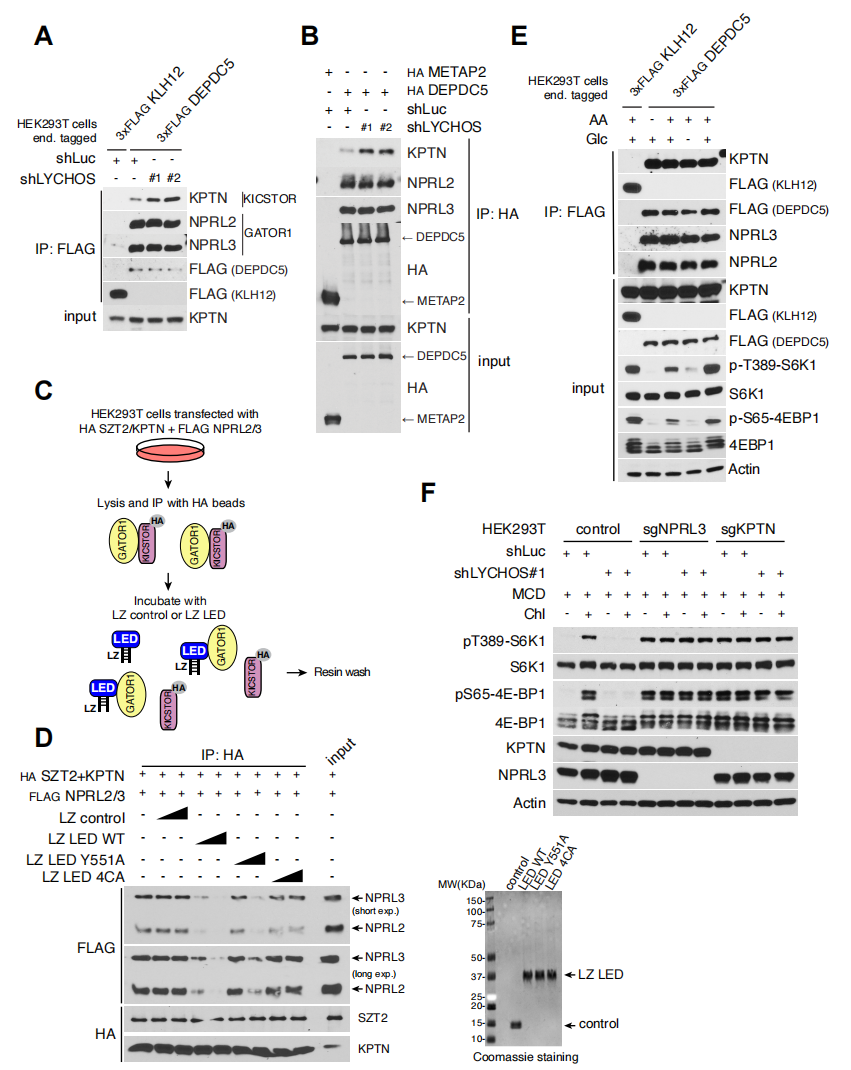
为了进一步阐述LYCHOS向mTORC1传递胆固醇丰度的机制,研究人员使用了邻近生物素标记技术结合蛋白质组学,将LYCHOS的C端与生物素连接酶TurboID相融合(LYCHOS-TiD,其准确定位于溶酶体上)(辅图10A)。尽管上述溶酶体“主列表”包括了几个已知的三聚体G蛋白,它们可以转导经典的GPCRs下游信号,但TiD实验(小编注:TurboID是斯坦福大学的Alice Ting课题组在2018年开发出的新邻近标记酶,这种新的邻近标记酶结合了大肠杆菌生物素连接酶(BioID)和抗坏血酸过氧化物酶(APEX)的优点,不仅催化效率高且不会对活细胞造成损害。除此之外,TurboID可以在室温(25°C)下实现有效的生物素化,而不像BioID和APEX系统所需的温度为37°C。通过将TurboID与感兴趣的目的蛋白融合表达于细胞内,在ATP与生物素的参与下,可在活细胞中对约10nm范围内的邻近蛋白进行生物素标记,标记时间约10分钟左右。)或免疫共沉淀(Co-IP)实验发现,它们不能与LYCHOS互作(辅图10B-C)。相反,LYCHOS-TiD特异性生物素化了GATOR1亚基NPRL2,NPRL3和DEPDC5,以及GATOR1相关KPTN,ITFG2,C12orf66和mTORC1(KICSTOR)复合物的SZT2亚基(图3A和3B)。为了证实临近生物素标记结果,由CRISPR-Cas9标记的LYCHOS-FLAG在下拉实验中与内源性NPRL2和NPRL3结合,尽管程度小于DEPDC5(辅图10D)。并没有观察到LYCHOS与KICSTOR亚基KPTN的结合,表明LYCHOS主要与GATOR1相互作用,而不是KICSTOR(辅图10D)。
研究人员为了进一步测试胆固醇是否调控LYCHOS-GATOR1的相互作用,进行了Co-IP实验,结果表明,与胆固醇耗尽的细胞相比,经过胆固醇处理的细胞中LYCHOS-FLAG与GATOR1亚基有更多的结合,DEPDC5与GATOR1亚基的相互作用没有发生改变(图3C)。此外,氨基酸对LYCHOS-GATOR1相互作用没有影响(辅图10E)。胆固醇刺激LYCHOS-GATOR1相互作用的功能呈剂量依赖性增加,半最大效应浓度浓度(EC50)为31.5μM,这与胆固醇激活mTORC1信号传导相一致(辅图11A和11B)。根据lyso-IP和质谱检测溶酶体脂质含量,研究发现EC50对应的胆固醇与磷脂的摩尔比为33%,尽管哪些胆固醇未被鞘磷脂结合并可被LYCHOS捕获尚不清楚(辅图11C)。总之,这些数据表明,LYCHOS通过与GATOR1相互作用并且抑制GATOR1来促进mTORC1信号传导。与这一结论一致的是,删除必需的GATOR1亚基NPRL3会导致组成型激活(小编注:组成型激活是指异常的不受控制的激活状态)mTORC1信号传导,而与胆固醇丰度或LYCHOS缺失无关(图3D)。通过GATOR1-Rag GTPase轴进一步支持LYCHOS的作用,当RagB发生突变后,(不通)该突变体不易受GATOR1介导的抑制而激活mTORC1信号,同时不受LYCHOS缺失的影响(辅图11D)。
SLC38A9也是胆固醇依赖性激活mTORC1所必需的。然而,SLC38A9和LYCHOS在信号传导的机理上有所不同。SLC38A9与Rag GTP酶和Ragator复合物结合,但不与GATOR1结合,而LYCHOS与GATOR1结合,但不与Rag GTP酶或Ragator结合(辅图12A-B)。用胆固醇处理细胞后,会减弱SLC38A9与Rag GTP酶的相互作用,可能是因为RagA在高胆固醇浓度的细胞中变成GTP过载。然而,在LYCHOS缺失的细胞中,SLC38A9-Rag GTP酶相互作用对胆固醇的变化不响应(图3E)。相反,无论SLC38A9状态如何,LYCHOS与GATOR1的相互作用都是呈胆固醇依赖性增强的(图3F)。
因此,通过与GATOR1的相互作用,LYCHOS在RagA的GTP过载上游起作用,而SLC38A9在其下游起作用(图3G)。尽管缺失GATOR1亚基NPRL3后完全挽救了LYCHOS缺失所带来的抑制作用,但在NPRL3缺失的细胞中抑制SLC38A9减弱了胆固醇依赖性mTORC1激活,进一步支持了LYCHOS和SLC38A9在不同但又类似途径上的功能(辅图12C)。
拓展阅读
邻近标记技术
生物大分子间的相互作用,在各种生命过程中广泛存在,并起着至关重要的调控作用。利用高通量筛选策略分析蛋白分子间相互作用的方法对生物学功能探索和疾病进程的理解具有重要的意义。虽然亲和纯化(AP/IP-MS)如Co-IP、RIP、Chip,以及依赖于酵母杂交体系的传统生化研究方法在前些年已经广泛应用,然而,这些方法都不擅长发现体内瞬时和微弱互作的分析。
邻近标记可直接在自然条件下的活细胞内进行,有利于捕获体内瞬时发生或微弱的蛋白互作关系,帮助科研人员更好地理解细胞内复杂的生物学过程。其原理是将一个具有特定催化连接活性的工具酶与目的蛋白融合,通过添加小分子底物(如生物素(biotin)),在工具酶的催化作用下小分子底物被活化并共价连接到酶邻近的内源蛋白上,被标记的蛋白经富集后进行质谱分析,可鉴定目的蛋白的互作或邻近的蛋白信息。邻近标记技术的关键是所使用的具有连接活性的工具酶,包括过氧化氢酶(e.g. APEX, HRP)和生物素连接酶(e.g. BioID, TurboID)等,这些酶催化产生的高反应活性小分子具有很短的寿命,因此邻近标记技术具有较高的空间特异性。这些工具酶从结构上来说其主要可分为完整型和拆分型两类,完整型的邻近标记酶主要用于研究单个目的蛋白的潜在互作蛋白,而拆分型的邻近标记酶则是用于研究与已知的蛋白复合体或互作蛋白存在关联的蛋白。
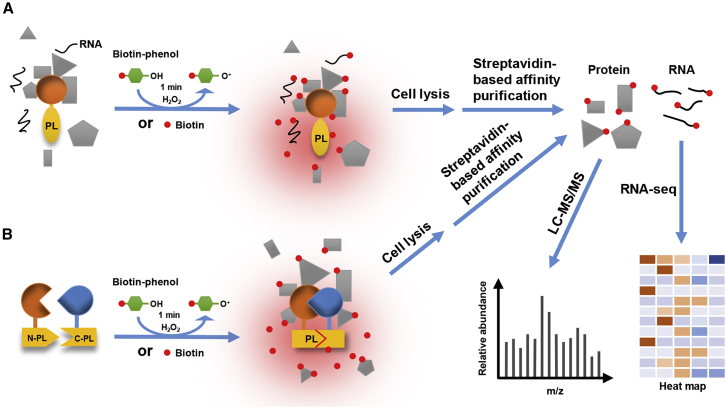
邻近标记系统的示意图
参考文献:
[1] Yang X, et al.Plant Commun. 2020 Dec 15;2(2):100137.
[2] Ummethum H, et al. Front Genet. 2020 May 12;11:450.
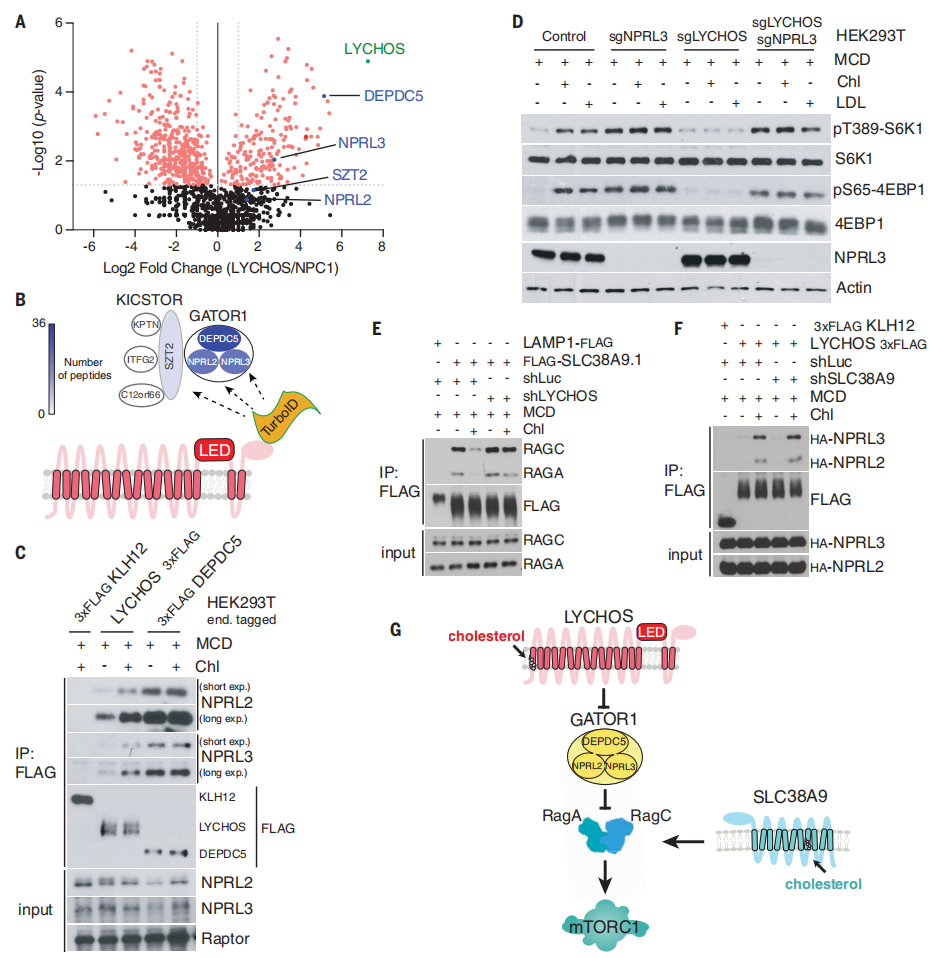
图3 LYCHOS通过胆固醇调节与GATOR1的相互作用促进mTORC1信号传导
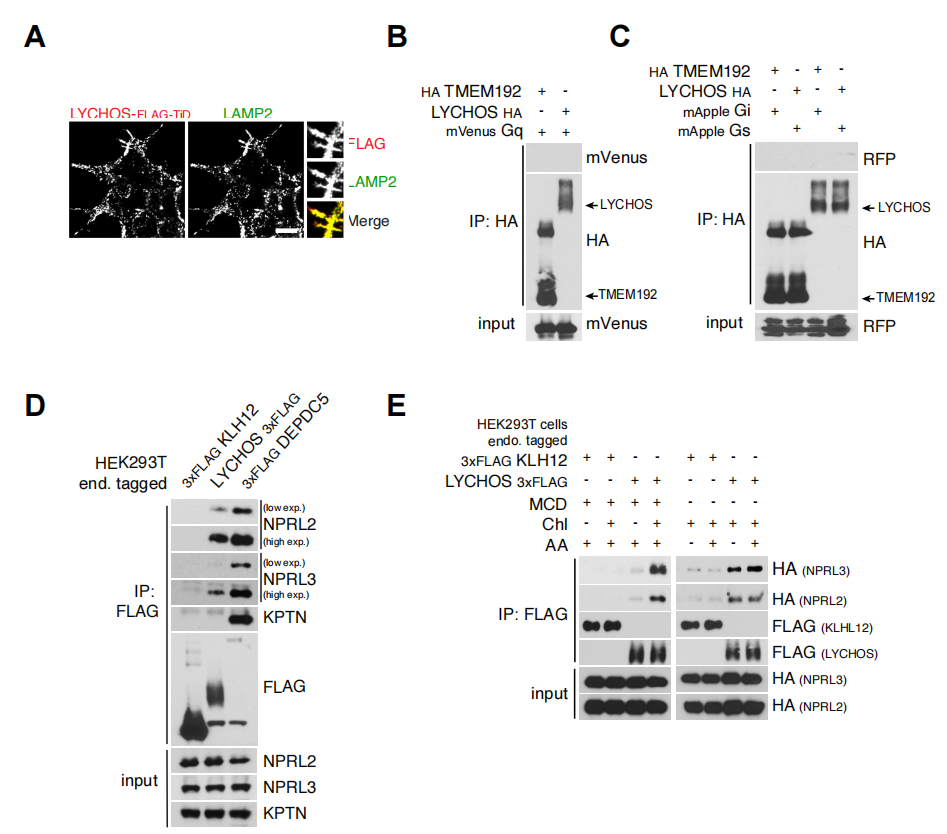
辅图10 LYCHOS通过与GATOR1相互作用促进mTORC1信号传导相关
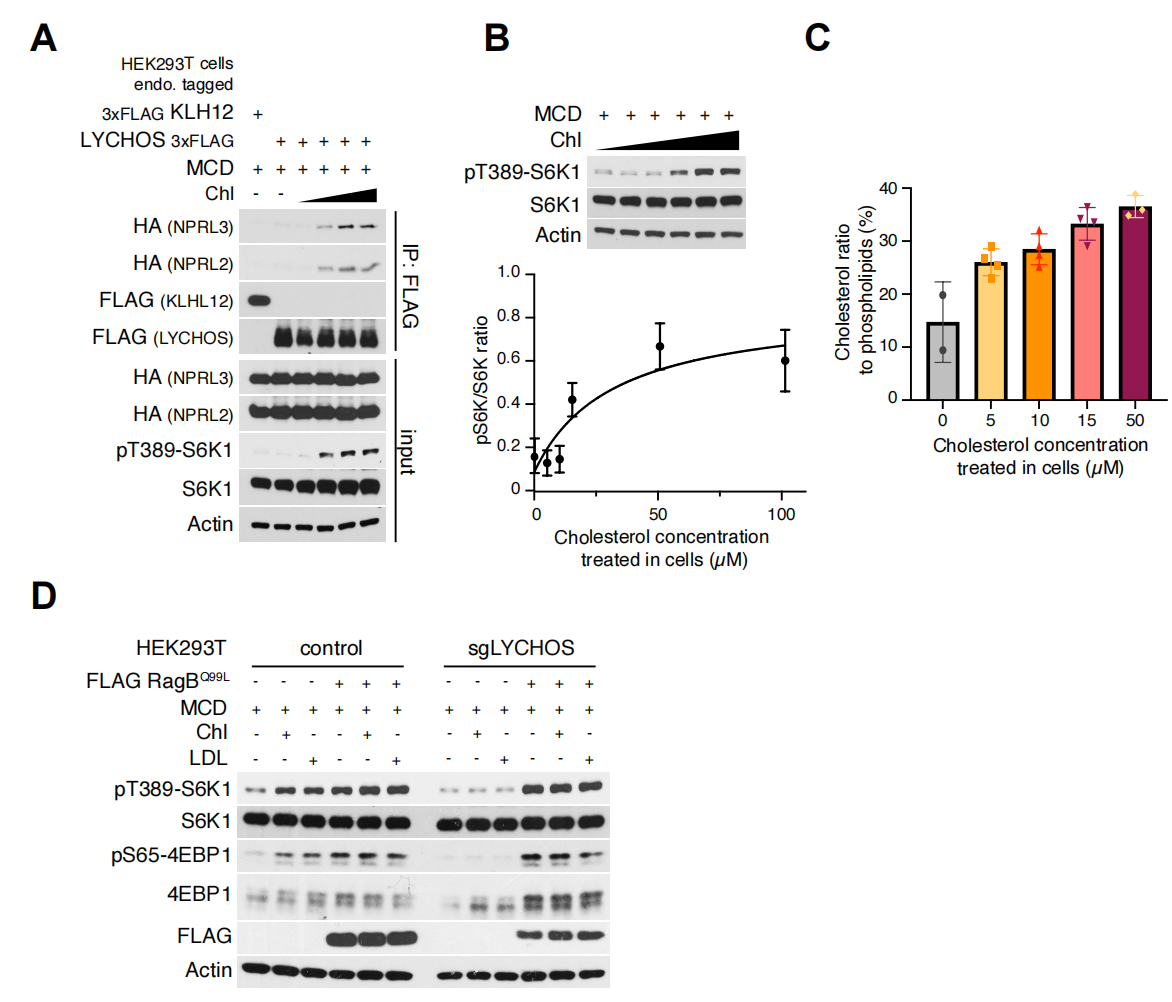
辅图11 胆固醇依赖性mTORC1激活的定量分析

辅图12 胆固醇依赖性mTORC1激活的定量分析
4.胆固醇通过LYCHOS LED破坏GATOR1-KICSTOR相互作用
研究人员之前的研究结果表明LED不与胆固醇结合,但仍然是胆固醇依赖mTORC1激活所必需的,因此研究人员测试了LED是否可能与GATOR1结合。为验证该猜想,当研究人员删除LED后消除了LYCHOS与GATOR1亚基NPRL2和NPRL3之间的胆固醇依赖性相互作用(辅图13A)。
接下来研究人员试图确定LED中对LYCHOS-GATOR1相互作用和mTORC1激活至关重要的保守氨基酸位点。LED含有一簇高度保守的半胱氨酸残基(图4A)。富含半胱氨酸的序列通过促进蛋白质-蛋白质以及蛋白质-脂质相互作用参与信号转导。当将四种保守的半胱氨酸突变为丙氨酸(C595→A,C604→A,C629→A,C638→A,统称为4CA)后,可以抑制LYCHOS依赖胆固醇介导的mTORC1激活的能力,尽管LYCHOS的4CA突变体具有与WT相当量的蛋白表达,并具有正常的溶酶体定位(图4B和辅图13B)。研究人员还测试了Tyr551,它从人类到斑马鱼都是保守的(图4A)。与4-半胱氨酸簇类似,Tyr551似乎也是LYCHOS信号传导活性所必需的,因为LYCHOSY551A突变体不能在LYCHOS缺失的细胞中恢复胆固醇依赖性的mTORC1激活(图4B)。与WT LYCHOS相反,Y551A和4CA LED突变体与GATOR1亚基NPRL2和NPRL3几乎检测不到相互作用,并且胆固醇处理并没有增强这种相互作用,这与它们不能参与胆固醇依赖性的激活mTORC1相一致(图4C)。与LYCHOS中GATOR1相互作用域一致,重组表达的WT LED具有亮氨酸拉链的环状结构,足以与GATOR1结合,而这种相互作用被Y551A和4CA突变所抑制(图4D)。
为了从机制上了解胆固醇调节LYCHOS-GATOR1的相互作用是如何促进mTORC1信号传导,研究人员测试了LED是否可以抑制GATOR1的RagA-GAP活性。然而,当在体外加入过量的GATOR1时,重组表达的LED和全长LYCHOS都不影响RagA上GATOR1依赖性的GTP到GDP的转化(辅图13C-E)。在营养充足的条件下,与LYCHOS WT细胞相比,LYCHOS缺失的细胞中GATOR1亚基DEPDC5和KICSTOR亚基KPTN之间的相互作用增强,表明LYCHOS可以抑制GATOR1-KICSTOR结合(辅图14A和14B)。胆固醇以LYCHOS依赖的方式抑制GATOR1-KICSTOR相互作用。在去除胆固醇的LYCHOS WT细胞中,DEPDC5与KICSTOR亚基KPTN和ITFG2具有相互作用,而添加胆固醇处理后,则抑制了这种相互作用(图4E)。相比之下,在缺乏LYCHOS的细胞中,DEPDC5和KICSTOR在胆固醇存在或不存在下都存在较强的相互作用(图4E)。WT LYCHOS的重新表达恢复了胆固醇对GATOR1-KICSTOR结合的抑制,而在4CA和Y551A LED突变体中并没有这种胆固醇依赖性抑制(图4E)。与LED在调节GATOR1-KICSTOR结合中的关键作用一致,重组表达的WT LED以剂量依赖性方式在体外破坏预先形成的GATOR1-KICSTOR复合物。相比之下,Y551和4CA突变体的添加量相当于WT,基本上是无效的(辅图14C和14D)。与胆固醇不同,氨基酸和葡萄糖刺激都不影响GATOR1-KICSTOR结合的强度(辅图14E),进一步支持LYCHOS的GATOR1-KICSTOR调控mTORC1上游胆固醇感应的特定作用。
总的来说,这些结果说明胆固醇与LYCHOS的渗透酶样区域结合后,LED连接GATOR1,拮抗其与KICSTOR的相互作用,从而干扰了GATOR1作为RagA/B的GAP能力。相反,当胆固醇浓度低时,LYCHOS不能干扰KICSTOR-GATOR1复合物,有利于RagA/B上的GATOR1依赖性GTP水解并导致mTORC1信号传导的抑制(图4F)。与此一致,删除必需的KICSTOR亚基KPTN后并不受LYCHOS缺失的影响,与GATOR1失活一致(辅图14F)。
拓展阅读
渗透酶
渗透酶(permease)又称载体蛋白(carrier protein)。载体蛋白几乎存在于所有类型的生物膜上,属于多次跨膜蛋白。每种载体蛋白能与特定的溶质结合,通过一系列构象改变介导溶质的跨膜转运。20世纪50年代中期,在细菌中发现单基因突变可导致半乳糖跨膜运输被阻断,从而发现了细菌质膜上负责β-半乳糖转运的载体蛋白。类似的基因突变在人的胱氨酸尿(cystinuria)遗传病患者中发现,这种病人的肾细胞和肠细胞不能将胱氨酸和半胱氨酸转运到血液,从而导致这些氨基酸在尿中积累并在肾中形成胱氨酸结石。
不同的生物膜往往含有各自功能相关的不同载体蛋白,质膜具有输入营养物糖、氨基酸和核苷酸的载体蛋白。线粒体内膜具有输入丙酮酸和ADP以及输出ATP的载体蛋白等。载体蛋白与酶类似:具有与溶质(底物)特异性结合的位点,所以每种载体蛋白对溶质具有高度选择性;转运过程具有类似于酶与底物作用的饱和动力学特征;既可被底物类似物竞争性地抑制,又可被某种抑制剂非竞争性抑制以及对pH有依赖性等。载体蛋白在与特异性溶质结合之后,是通过自身构象的变化,将于它结合的溶质转移到膜的另一侧。而溶质载体(SLC)家族(一组膜转运蛋白)在介导溶质转运的过程中并不改变自身的构象。此外,虽然渗透酶(又称为载体蛋白)和SLC家族都能够控制细胞营养或能源物质的摄取和转运,并且参与体内必需离子或微量营养素的吸收,但是SLC家族还参与了参与神经递质的跨膜转运和信号传导,如转运血清素、多巴胺的SLC6,转运乙酰胆碱、单胺递质的SLC18以及转运谷氨酸的SLC1等,而载体蛋白不具有这一功能。
参考文献:
[1] 细胞生物学.丁明孝主编-5版-北京高等教育出版社.2020.5.SBN 978-7-04-047157-1.
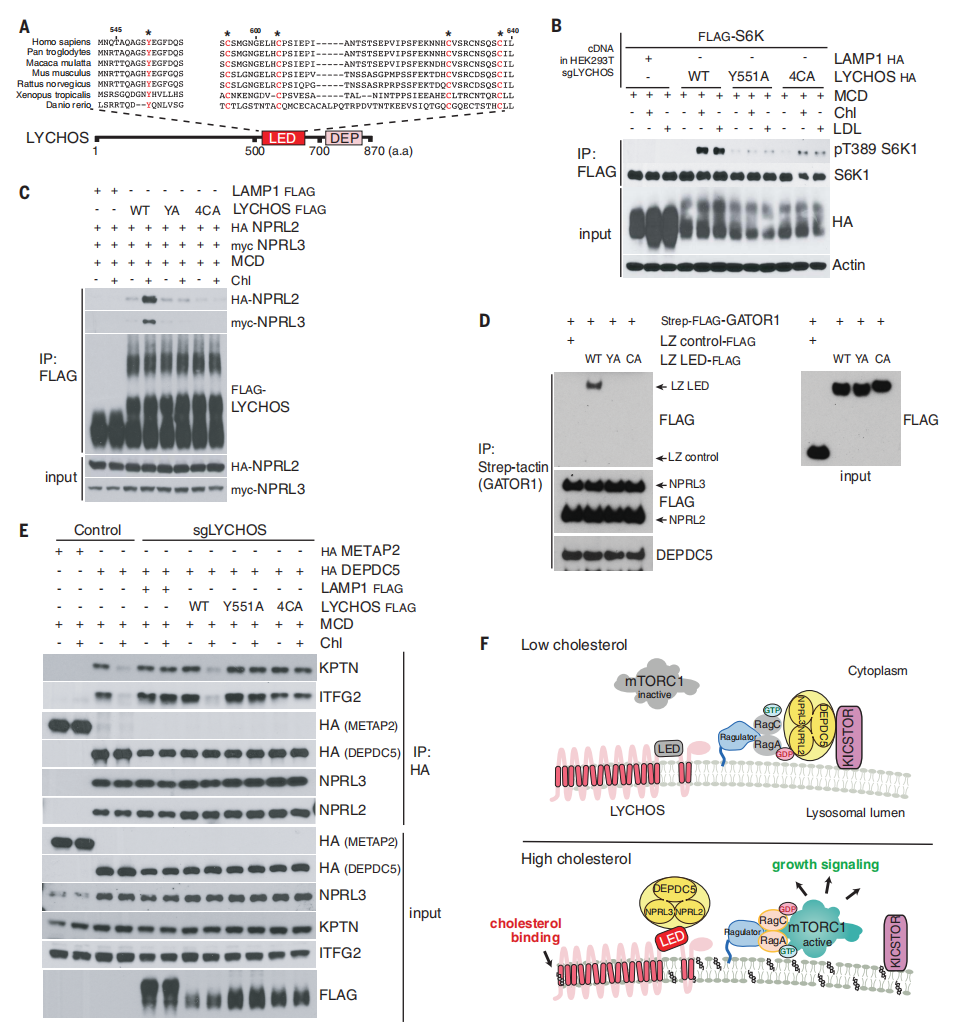
图4 胆固醇通过LYCHOS LED 破坏GATOR1-KICSTOR相互作用
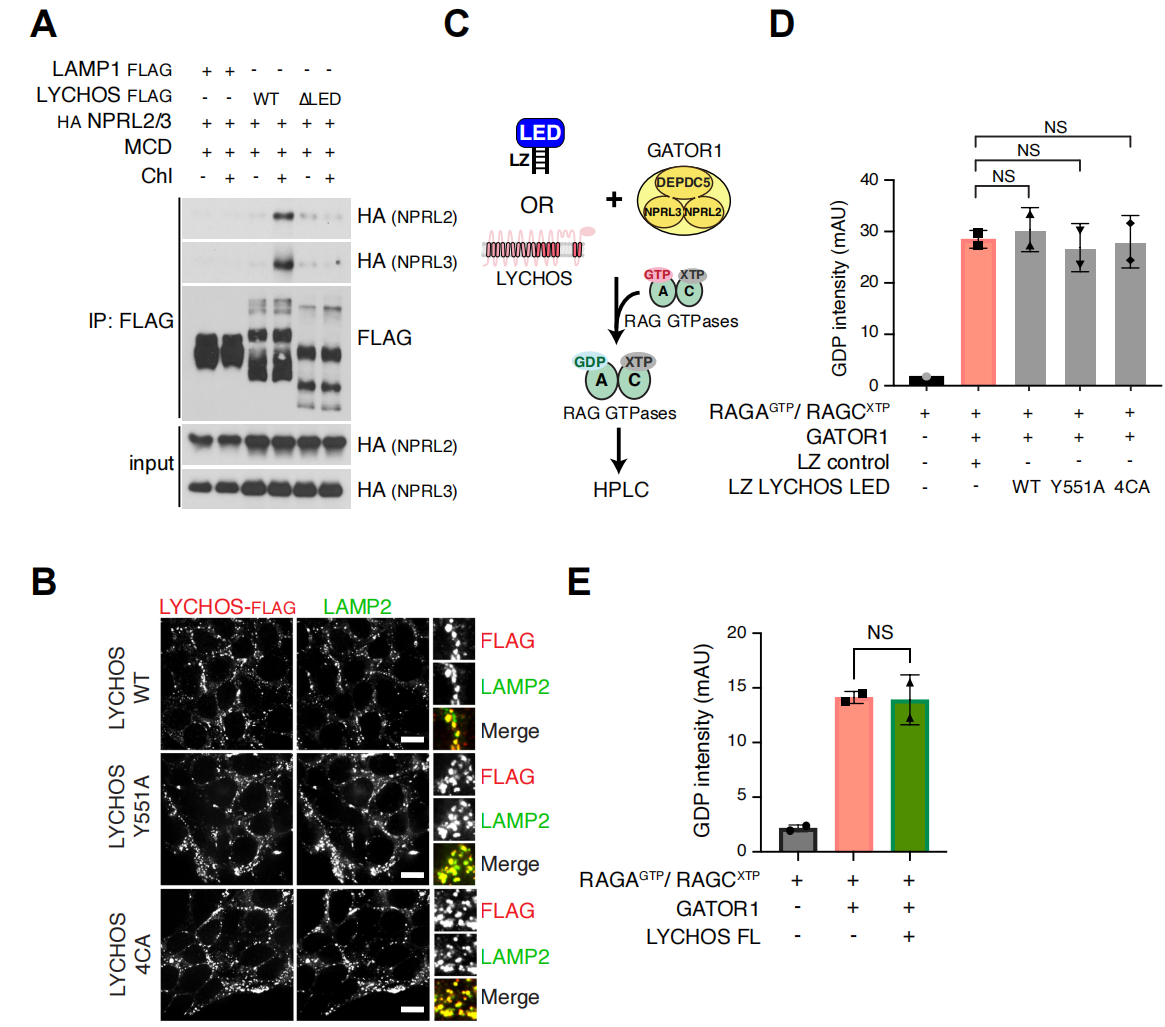
辅图13 LYCHOS不抑制GATOR1 GAP对Rag GTPGAP活性
辅图14 LYCHOS抑制GATOR1-KICSTOR的相互作用
总结
本文研究人员研究发现了溶酶体上特异性胆固醇感受器蛋白LYCHOS。并确定了LYCHOS作为一种多结构域跨膜蛋白,其可以接收胆固醇刺激激活mTORC1信号转导。胆固醇结合到LYCHOS的N-末端渗透酶样结构域,突变该位点会抑制mTORC1的激活。在高胆固醇浓度下,LYCHOS通过一个面向细胞质的保守环与激活Rag GTPase的GATOR1复合体结合。通过隔离GATOR1与KICSTOR, LYCHOS促进了胆固醇和Rag依赖性的mTORC1从内质网向溶酶体的募集。因此,LYCHOS在溶酶体途径中对胆固醇敏感,并将胆固醇浓度与mTORC1依赖的合成代谢信号结合。
原文链接:https://www.science.org/doi/epdf/10.1126/science.abg6621
关注微信公众号代谢学人
了解更多代谢前沿资讯

https://m.sciencenet.cn/blog-3483272-1363655.html
上一篇:代谢学人--Nature:U,执行A计划!线粒体UCP1/AAC机制大揭秘
下一篇:代谢学人--Cell子刊近期代谢研究精选